Để giúp các em học sinh ôn luyện thật tốt để chuẩn bị cho kì thi học sinh giỏi sắp đến, HOC247 xin gửi đến Đề thi học sinh giỏi môn Hóa học 9- Phòng GD & ĐT huyện Bù Gia Mập có đáp án. Mời các em học sinh cùng tham khảo nội dung chi tiết bên dưới đây.
PHÒNG GD & ĐT BÙ GIA MẬP
ĐỀ THI HỌC SINH GIỎI MÔN HÓA HỌC 9
THỜI GIAN: 150 PHÚT
Câu 1: (3 điểm)
- Từ các chất Na2O, CaO, H2O, CuSO4, FeCl3 . Viết các phương trình hóa học điều chế các hiđroxit tương ứng.
- Có 5 gói bột trắng là KNO3, K2CO3, K2SO4, BaCO3, BaSO4. Chỉ được dùng thêm nước, khí cacbon đioxit và các dụng cụ cần thiết. Hãy nhận biết từng chất bột trắng nói trên.
Câu 2: (4 điểm)
- Cho hỗn hợp gồm 3 chất rắn: Al2O3, SiO2 và Fe2O3 vào dung dịch chứa một chất tan A thì thu được một chất kết tủa B duy nhất. Hãy cho biết A, B có thể là những chất gì? Cho ví dụ và viết phương trình hóa học minh họa.
- Đơn chất của hai nguyên tố X, Y ở điều kiện thường là chất rắn. Số mol X trong 8,4 gam nhiều hơn số mol Y trong 6,4 gam là 0,15mol. Biết khối lượng mol của X nhỏ hơn khối lượng mol của Y là 8 gam.
a. Xác định nguyên tố X, Y
b. Các nguyên tố X, Y có thể tạo nên những loại hợp chất nào? Cho ví dụ minh họa.
Câu 3: (3 điểm)
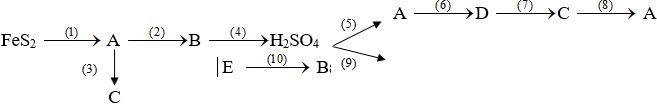
Xác định các chất A, B, C, D, E và viết phương trình hóa học thực hiện dãy chuyển đổi hóa học sau:
Câu 4: (4 điểm) A là dung dịch H2SO4, B là dung dịch NaOH.
1. Trộn 50 ml dung dịch A với 50 ml dung dịch B được dung dịch C. Cho quỳ tím vào dung dịch C thấy có màu đỏ. Thêm từ từ dung dịch NaOH 0,1M vào dung dịch C đến khi quỳ trở lại màu tím thì thấy hết 20 ml dung dịch NaOH.
2. Trộn 50ml dung dịch A với 100ml dung dịch B thu được dung dịch D. Cho quỳ tím vào dung dịch D thấy có màu xanh. Thêm từ từ dung dịch HCl 0,1M vào dung dịch D đến khi quỳ trở lại màu tím thấy hết 20 ml dung dịch HCl.
Tính nồng độ mol của các dung dịch A và B.
Câu 5: (6 điểm) Hòa tan hỗn hợp kim loại Na và Ba (có số mol bằng nhau) vào nước thu được dung dịch A và 6,72 lít khí (đktc).
1. Cần dùng bao nhiêu ml dung dịch HCl 0,1M để trung hòa 10% dung dịch A.
2. Cho 56 ml CO2 (đktc) hấp thụ hết vào 10% dung dịch A. Tính khối lượng kết tủa thu được.
3. Thêm m gam NaOH vào 10% dung dịch A ta được dung dịch B. Cho dung dịch B tác dụng với 100 ml dung dịch Al2(SO4)3 0,2M thu được kết tủa C. Tính m để cho khối lượng kết tủa C là lớn nhất, bé nhất. Tính khối lượng kết tủa lớn nhất, bé nhất.
ĐÁP ÁN
|
CÂU |
ĐÁP ÁN |
ĐIỂM |
|
1 |
1. Na2O + H2O → 2NaOH CaO + H2O → Ca(OH)2 CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4 CuSO4 + Ca(OH)2 → Cu(OH)2↓ + CaSO4 FeCl3 + 3NaOH → Fe(OH)3↓+ 3NaCl 2FeCl3 + 3Ca(OH)2 → 2Fe(OH)3↓+ 3CaCl2 |
1,5 điểm
|
|
2. - Lấy mẫu thử - Hòa tan lần lượt các mẫu thử vào nước: Hai mẫu không tan là BaCO3 và BaSO4, ba mẫu tan là KNO3, K2CO3 và K2SO4. - Sục khí CO2 vào 2 ống nghiệm chứa 2 mẫu không tan: Mẫu tan là BaCO3 mẫu không tan là BaSO4: BaCO3 + CO2 + H2O → Ba(HCO3)2 - Lấy dung dịch Ba(HCO3)2 thu được cho vào 3 mẫu muối kali tan: Dung dịch không tạo kết tủa trắng là KNO3: K2CO3 + Ba(HCO3)2 → BaCO3 ↓ + 2KHCO3 K2SO4 + Ba(HCO3)2 → BaSO4 ↓ + 2KHCO3 - Sục khí CO2 vào 2 ống nghiệm có kết tủa trên: kết tủa nào tan ra thì muối ban đầu là K2CO3. Muối kia là K2SO4. |
1,5 điểm |
|
|
2 |
1. Ta thấy hỗn hợp gồm: Fe2O3 là oxit bazo, SiO2 là oxit axit, Al2O3 là oxit lưỡng tính, nên khi cho vào dung dịch chứa một chất tan A thu được một chất rắn duy nhất B sẽ xảy ra hai trường hợp sau: * Trường hợp 1: A là kiềm (VD: NaOH), Al2O3 và SiO2 tan còn chất rắn không tan là Fe2O3 (Chất B). PTHH: Al2O3 + 2NaOH → 2NaAlO2 + H2O SiO2 + 2NaOH → Na2SiO3 + H2O * Trường hợp 2: Chất A là axit (VD: dd HCl), Al2O3 và Fe2O3 tan còn SiO2 không tan (Chất B). PTHH: Al2O3 + 6HCl → 2AlCl3 + 3H2O Fe2O3 + 6HCl → 2FeCl3 + 3H2O 2. a) Đặt khối lượng mol của nguyên tố X là x Khối lượng mol của nguyên tố Y là x + 8 Ta có: Giải PT trên ta được: x = 24 X là Magie (Mg) KL mol của nguyên tố Y = 24 + 8 = 32 Y là Lưu huỳnh (S) b) Mg và S tạo được các loại hợp chất: - Oxit bazo: MgO , Oxit axit: SO2, SO3 - Bazo: Mg(OH)2 - Axit: H2SO3, H2SO4 - Muối: MgS, MgSO3, MgSO4 … |
2 điểm
1 điểm
1 điểm |
|
3 |
* A: SO2 C: Na2SO3 E: Na2SO4 B : SO3 D: H2SO3 * PTHH: (1) 8FeS2 + 11O2 4Fe2O3 + 8SO2↑ (2) 2SO2 + O2 2SO3 (3) SO3 + 2NaOH → Na2SO3 + H2O (4) SO3 + H2O → H2SO4 (5) H2SO4 + Na2SO3 → Na2SO4 + H2O + SO2↑ (6) SO2 + H2O → H2SO3 (7) H2SO3 + 2NaOH →Na2SO3 + 2H2O (8) Na2SO3 + 2HCl → 2NaCl + SO2↑ + H2O (9) H2SO4 + 2NaOH → Na2SO4 + 2H2O (10) Na2SO4 + BaCl2 → BaSO4 ↓+ 2NaCl |
0,5 điểm
2,5 điểm |
|
4 |
Đặt nồng độ mol của dd H2SO4 là x, của dd NaOH là y. Theo gt: Số mol H2SO4 = 0,05x Số mol NaOH = 0,05y PTHH: H2SO4 + 2NaOH → Na2SO4 + 2H2O (1) 0,025y 0,05y Theo PTHH (1) : Số mol H2SO4 dư = 0,05x – 0,025y Số mol NaOH trung hòa axit dư = 0,1. 0,02 = 0,002 mol Số mol H2SO4 dư = 0,002 : 2 = 0,001 mol 0,05x – 0,025 y = 0,001 Theo gt: Số mol H2SO4 = 0,05x Số mol NaOH = 0,1y PTHH: H2SO4 + 2NaOH →Na2SO4 + 2H2O (1) 0,05x 0,1x Theo PTHH(1): Số mol NaOH dư = 0,1y – 0,1x PTHH: HCl + NaOH → NaCl + H2O (2) 0,002 mol Số mol HCl trong hòa NaOH dư = 0,1 . 0,02 = 0,002 mol 0,1y – 0,1x = 0,002 Ta có hệ PT: 0,05x – 0,025 y = 0,001 0,1y – 0,1x = 0,002 Giải hệ PT ta được: x = 0,06 ; y = 0,08 Nồng độ dung dịch H2SO4 là 0,06M Nồng độ dung dịch NaOH là 0,08M |
1,5 điểm
1,5 điểm
1 điểm |
---Để xem đầy đủ nội dung và đáp án của đề thi các em vui lòng xem online hoặc tải về máy---
Trên đây là trích dẫn một phần nội dung tài liệu Đề thi học sinh giỏi môn Hóa học 9- Phòng GD & ĐT huyện Bù Gia Mập có đáp án. Để xem thêm nhiều tài liệu tham khảo hữu ích khác các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Ngoài ra các em học sinh có thể tham khảo các tài liệu cùng chuyên mục:
- Đề thi học sinh giỏi môn Hóa học 9- Phòng GD & ĐT Bù Đăng có đáp án
- Bộ đề thi học sinh giỏi môn Địa lí 9- Trường THCS Trần Văn Ơn có đáp án
Chúc các em học tốt!