Vß╗øi mong muß╗æn c├│ th├¬m t├Āi liß╗ću gi├║p c├Īc em hß╗Źc sinh lß╗øp 10 ├┤n tß║Łp chuß║®n bß╗ŗ trŲ░ß╗øc k├¼ thi giß╗»a Hß╗Źc k├¼ 2 sß║»p tß╗øi, HOC247 giß╗øi thiß╗ću ─æß║┐n c├Īc em t├Āi liß╗ću Bß╗Ö 2 ─æß╗ü thi giß╗»a hß╗Źc k├¼ 2 m├┤n Ho├Ī 10 CTST n─ām hß╗Źc 2023 trŲ░ß╗Øng THPT Trß║¦n Ph├║ c├│ ─æ├Īp ├Īn do HOC247 bi├¬n tß║Łp v├Ā tß╗Ģng hß╗Żp vß╗øi phß║¦n ─æß╗ü v├Ā ─æ├Īp ├Īn c├│ lß╗Øi giß║Żi chi tiß║┐t, bß╗Ö t├Āi liß╗ću sß║Į gi├║p c├Īc em tß╗▒ luyß╗ćn tß║Łp l├Ām ─æß╗ü. Hi vß╗Źng t├Āi liß╗ću n├Āy sß║Į c├│ ├Łch cho c├Īc em ├┤n tß║Łp m├┤n Ho├Ī hß╗Źc lß╗øp 10 CTST, ch├║c c├Īc em c├│ kß║┐t quß║Ż hß╗Źc tß║Łp tß╗æt!
|
TRŲ»ß╗£NG THPT TRß║”N PH├Ü |
─Éß╗Ć THI GIß╗«A Hß╗īC K├ī 2 M├öN: H├ōA Hß╗īC 10 N─éM Hß╗īC 2022-2023 Thß╗Øi gian l├Ām b├Āi: 45 ph├║t |
─Éß╗Ć Sß╗É 1
PHß║”N I: TRß║«C NGHIß╗åM (7 ─ÉIß╗éM)
C├óu 1. Phß║Żn ß╗®ng ho├Ī hß╗Źc xß║Ży ra trong th├Ł nghiß╗ćm n├Āo sau ─æ├óy l├Ā phß║Żn ß╗®ng oxi ho├Ī ŌĆō khß╗Ł?
A. Cho mß║®u ─æ├Ī v├┤i v├Āo dung dß╗ŗch HCl.
B. Nhiß╗ćt ph├ón Mg(OH)2 th├¼ thu ─æŲ░ß╗Żc MgO m├Āu trß║»ng.
C. Cho kim loß║Īi Al t├Īc dß╗źng vß╗øi dung dß╗ŗch HCl c├│ kh├Ł tho├Īt ra.
D. Nhß╗Å dung dß╗ŗch AgNO3 v├Āo dung dß╗ŗch HCl thß║źy c├│ kß║┐t tß╗¦a trß║»ng.
C├óu 2. Quy tß║»c x├Īc ─æß╗ŗnh sß╗æ oxi ho├Ī n├Āo sau ─æ├óy l├Ā kh├┤ng ─æ├║ng?
A. Trong ─æa sß╗æ c├Īc hß╗Żp chß║źt, sß╗æ oxi ho├Ī cß╗¦a hydrogen l├Ā +1.
B. Kim loß║Īi kiß╗üm (nh├│m IA) lu├┤n c├│ sß╗æ oxi ho├Ī +1 trong hß╗Żp chß║źt.
C. Oxygen lu├┤n c├│ sß╗æ oxi ho├Ī l├Ā ŌĆō2.
D. Trong hß╗Żp chß║źt, fluorine c├│ sß╗æ oxi ho├Ī l├Ā ŌĆō1.
C├óu 3. Sß╗æ oxi ho├Ī cß╗¦a phosphorus trong hß╗Żp chß║źt PH3 l├Ā
A. ŌĆō3.
B. +3.
C. ŌĆō5.
D. +5.
C├óu 4. Sß╗æ oxi ho├Ī cß╗¦a nitrogen trong hß╗Żp chß║źt l├Ā
A. ŌĆō4.
B. +4.
C. ŌĆō3.
D. +3.
C├óu 5. Sulfur trong hß╗Żp chß║źt n├Āo sau ─æ├óy c├│ sß╗æ oxi ho├Ī l├Ā +4?
A. H2S.
B. SO3.
C. H2SO4.
D. Na2SO3.
C├óu 6. Cho c├Īc hß╗Żp chß║źt sau: FeO; FeCl2; Fe(OH)3; Fe2O3; FeSO4. Sß╗æ hß╗Żp chß║źt trong ─æ├│ sß║»t c├│ sß╗æ oxi ho├Ī +2 l├Ā
A. 1.
B. 2.
C. 4.
D. 3.
C├óu 7. Cho phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc sau: 2H2S + 3O2 ŌåÆ 2SO2 + 2H2O. Chß║źt khß╗Ł trong phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc l├Ā
A. O2.
B. H2S.
C. SO2.
D. H2O.
C├óu 8. Chß║źt bß╗ŗ oxi ho├Ī l├Ā
A. chß║źt nhŲ░ß╗Øng electron.
B. chß║źt nhß║Łn electron.
C. chß║źt c├│ sß╗æ oxi ho├Ī giß║Żm xuß╗æng sau phß║Żn ß╗®ng.
D. chß║źt c├│ sß╗æ oxi ho├Ī kh├┤ng thay ─æß╗Ģi sau phß║Żn ß╗®ng.
C├óu 9. Copper(II) oxide (CuO) bß╗ŗ khß╗Ł bß╗¤i ammonia (NH3) theo phß║Żn ß╗®ng sau:
NH3 + CuO ŌåÆ Cu + N2+ H2O
Tß╗Ģng hß╗ć sß╗æ c├ón bß║▒ng (tß╗æi giß║Żn) cß╗¦a phß║Żn ß╗®ng l├Ā?
A. 11.
B. 12.
C. 13.
D. 14.
C├óu 10. Nguy├¬n tß╗Ł carbon trong trŲ░ß╗Øng hß╗Żp n├Āo sau ─æ├óy vß╗½a thß╗ā hiß╗ćn t├Łnh khß╗Ł, vß╗½a thß╗ā hiß╗ćn t├Łnh oxi ho├Ī khi tham gia phß║Żn ß╗®ng ho├Ī hß╗Źc?
A. C.
B. CO2.
C. CaCO3.
D. CH4.
C├óu 11. Cho c├Īc phß║Żn ß╗®ng sau:
(a) 4HCl + PbO2 ŌåÆ PbCl2 + Cl2 + 2H2O.
(b) HCl + NH4HCO3 ŌåÆ NH4Cl + CO2 + H2O.
(c) 2HCl + 2HNO3 ŌåÆ 2NO2 + Cl2 + 2H2O.
(d) 2HCl + Zn ŌåÆ ZnCl2 + H2.
Sß╗æ phß║Żn ß╗®ng trong ─æ├│ HCl thß╗ā hiß╗ćn t├Łnh khß╗Ł l├Ā
A. 2.
B. 3.
C. 1.
D. 4.
C├óu 12. Cho 6,4 gram Cu t├Īc dß╗źng hß║┐t vß╗øi lŲ░ß╗Żng dŲ░ dung dß╗ŗch H2SO4 ─æß║Ęc, n├│ng thu ─æŲ░ß╗Żc V l├Łt kh├Ł SO2 ß╗¤ ─æiß╗üu kiß╗ćn chuß║®n. Gi├Ī trß╗ŗ cß╗¦a V l├Ā
A. 4,958.
B. 2,479.
C. 3,720.
D. 0,297.
C├óu 13. Cho ─æinh sß║»t v├Āo ß╗æng nghiß╗ćm chß╗®a 3 ml HCl, sß║»t phß║Żn ß╗®ng vß╗øi HCl theo phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc sau: Fe + 2HCl ŌåÆ FeCl2 + H2. Nhß║Łn x├®t n├Āo sau ─æ├óy l├Ā ─æ├║ng?
A. Fe nhŲ░ß╗Øng electron n├¬n l├Ā chß║źt bß╗ŗ khß╗Ł.
B. Ion H+ nhß║Łn electron n├¬n l├Ā chß║źt oxi ho├Ī.
C. Qu├Ī tr├¼nh oxi ho├Ī: \(\text{2}\overset{\text{+1}}{\mathop{\text{H}}}\,\text{+2e}\to {{\text{H}}_{\text{2}}}\text{.}\)
D. Qu├Ī tr├¼nh khß╗Ł: \(\overset{\text{0}}{\mathop{\text{Fe}}}\,\to \overset{\text{+2}}{\mathop{\text{Fe}}}\,\,\text{+2e}\)
C├óu 14. Cho phŲ░ŲĪng tr├¼nh h├│a hß╗Źc: aAl + bH2SO4 ŌåÆ cAl2(SO4)3 + dSO2 + eH2O.
Tß╗ē lß╗ć a : b l├Ā
A. 1 : 1.
B. 2 : 3.
C. 1 : 3.
D. 1 : 2.
C├óu 15. Cho c├Īc phß║Żn ß╗®ng sau:
(a) Phß║Żn ß╗®ng nhiß╗ćt ph├ón Cu(OH)2 tß║Īo th├Ānh CuO.
(b) Phß║Żn ß╗®ng trung ho├Ā (acid t├Īc dß╗źng vß╗øi base).
(c) Phß║Żn ß╗®ng nung clinker xi m─āng.
(d) Phß║Żn ß╗®ng oxi ho├Ī glucose trong cŲĪ thß╗ā.
Sß╗æ phß║Żn ß╗®ng thu nhiß╗ćt l├Ā
A. 1.
B. 2.
C. 3.
D. 4.
C├óu 16. Cho phß║Żn ß╗®ng sau:
2H2(g) + O2(g) ŌåÆ 2H2O(g) \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{0}}\text{=}\,-\text{483,64kJ}\text{.}\)
Enthalpy tß║Īo th├Ānh chuß║®n cß╗¦a H2O(g) l├Ā
A. ŌĆō 483,64 kJ/ mol.
B. 483,64 kJ/ mol.
C. ŌĆō 241,82 kJ/ mol.
D. 241,82 kJ/ mol.
C├óu 17. Cho c├Īc phß║Żn ß╗®ng sau:
(a) C + O2(g) ŌåÆ CO2(g); \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{0}}\text{=}\,-393,5\text{kJ}\)
(b) 2Al(s) + 3/2(g) ŌåÆ Al2O3(s); \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{0}}\text{=}\,-1675,7\text{kJ}\)
(c) CH4(g) + H2O(l) ŌåÆ CO(g) + 3H2(g); \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{0}}\text{=}\,249,9\text{kJ}\)
(d) H2(g) + Cl2(g) ŌåÆ 2HCl(g); \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{0}}\text{=}\,-\text{184,6kJ}\text{.}\)
Sß╗æ phß║Żn ß╗®ng toß║Ż nhiß╗ćt l├Ā
A. 4.
B. 3.
C. 2.
D. 1.
C├óu 18. Cho giß║Żn ─æß╗ō sau:
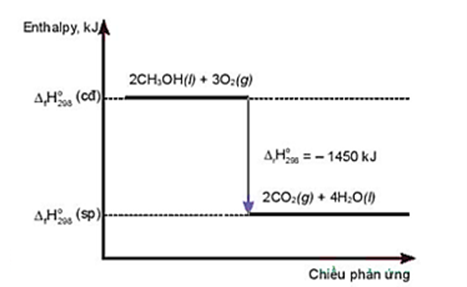
Ph├Īt biß╗āu ─æ├║ng l├Ā
A. Phß║Żn ß╗®ng thu nhiß╗ćt.
B. Nhiß╗ćt lŲ░ß╗Żng thu v├Āo cß╗¦a phß║Żn ß╗®ng l├Ā ŌĆō 1450 kJ.
C. Phß║Żn ß╗®ng cß║¦n cung cß║źp nhiß╗ćt li├¬n tß╗źc.
D. Nhiß╗ćt lŲ░ß╗Żng toß║Ż ra cß╗¦a phß║Żn ß╗®ng l├Ā 1450 kJ.
C├óu 19. Nhiß╗ćt k├©m theo (nhiß╗ćt lŲ░ß╗Żng toß║Ż ra hay thu v├Āo) cß╗¦a mß╗Öt phß║Żn ß╗®ng ho├Ī hß╗Źc ß╗¤ ├Īp suß║źt kh├┤ng ─æß╗Ģi (v├Ā thŲ░ß╗Øng ß╗¤ mß╗Öt nhiß╗ćt ─æß╗Ö x├Īc ─æß╗ŗnh) gß╗Źi l├Ā
A. enthalpy tß║Īo th├Ānh chuß║®n cß╗¦a mß╗Öt chß║źt.
B. enthalpy tß║Īo th├Ānh cß╗¦a mß╗Öt chß║źt.
C. biß║┐n thi├¬n enthalpy chuß║®n cß╗¦a phß║Żn ß╗®ng ho├Ī hß╗Źc.
D. biß║┐n thi├¬n enthalpy cß╗¦a phß║Żn ß╗®ng.
C├óu 20. Cho phß║Żn ß╗®ng ho├Ī hß╗Źc sau: 2Na(s) + Cl2(g) ŌåÆ 2NaCl(s).
Biß║┐n thi├¬n enthalpy chuß║®n cß╗¦a phß║Żn ß╗®ng n├Āy ─æŲ░ß╗Żc t├Łnh theo c├┤ng thß╗®c l├Ā
A. \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{0}}\text{=}\,{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{0}}\text{(Na(s))+}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{0}}\text{(C}{{\text{l}}_{\text{2}}}\text{(g))-}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{0}}\text{(NaCl(s))}\)
B. \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{0}}\text{=}\,{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{0}}\text{(NaCl(s))}\,-{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{0}}\text{(Na(s))}\,-{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{0}}\text{(C}{{\text{l}}_{2}}\text{(g))}\)
C. \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{0}}\text{=}\,2.{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{0}}\text{(Na(s))+}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{0}}\text{(C}{{\text{l}}_{\text{2}}}\text{(g))}\,-2.{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{0}}\text{(NaCl(s))}\)
D. \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{0}}\text{=}\,2.{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{0}}\text{(NaCl(s))}\,-{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{0}}\text{(C}{{\text{l}}_{\text{2}}}\text{(g))}\,-2.{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{0}}\text{(Na(s))}\)
C├óu 21. Cho phß║Żn ß╗®ng sau: CaCO3(s) ŌåÆ CaO(s) + CO2(g).
ß╗× ─æiß╗üu kiß╗ćn chuß║®n, biß║┐n thi├¬n enthalpy cß╗¦a phß║Żn ß╗®ng l├Ā (Biß║┐t nhiß╗ćt tß║Īo th├Ānh (kJ/mol) cß╗¦a CaCO3, CaO v├Ā CO2 lß║¦n lŲ░ß╗Żt l├Ā ŌĆō1 207, ŌĆō635 v├Ā ŌĆō393,5)
A. +178,5 kJ.
B. ŌĆō178,5 kJ.
C. + 357 kJ.
D. ŌĆō357 kJ.
C├óu 22. Cho c├Īc ph├Īt biß╗āu sau:
(a). Tß║źt cß║Ż c├Īc phß║Żn ß╗®ng ch├Īy ─æß╗üu toß║Ż nhiß╗ćt.
(b). Phß║Żn ß╗®ng toß║Ż nhiß╗ćt l├Ā phß║Żn ß╗®ng giß║Żi ph├│ng n─āng lŲ░ß╗Żng dŲ░ß╗øi dß║Īng nhiß╗ćt.
(c). Tß║źt cß║Ż c├Īc phß║Żn ß╗®ng m├Ā chß║źt tham gia c├│ chß╗®a nguy├¬n tß╗æ oxygen ─æß╗üu toß║Ż nhiß╗ćt.
(d). Phß║Żn ß╗®ng thu nhiß╗ćt l├Ā phß║Żn ß╗®ng hß║źp thß╗ź n─āng lŲ░ß╗Żng dŲ░ß╗øi dß║Īng nhiß╗ćt.
(e). LŲ░ß╗Żng nhiß╗ćt m├Ā phß║Żn ß╗®ng hß║źp thß╗ź hay giß║Żi ph├│ng kh├┤ng phß╗ź thuß╗Öc v├Āo ─æiß╗üu kiß╗ćn thß╗▒c hiß╗ćn phß║Żn ß╗®ng v├Ā thß╗ā tß╗ōn tß║Īi cß╗¦a chß║źt trong phß║Żn ß╗®ng.
(g). Sß╗▒ ch├Īy cß╗¦a nhi├¬n liß╗ću (x─āng, dß║¦u, kh├Ł gas, than, gß╗Ś,...) l├Ā nhß╗»ng C├óu vß╗ü phß║Żn ß╗®ng thu nhiß╗ćt v├¼ cß║¦n phß║Żi khŲĪi m├Āo.
Sß╗æ ph├Īt biß╗āu ─æ├║ng l├Ā
A. 1.
B. 2.
C. 3.
D. 4.
C├óu 23. Ph├Īt biß╗āu n├Āo sau ─æ├óy ─æ├║ng?
A. ─Éiß╗üu kiß╗ćn chuß║®n l├Ā ─æiß╗üu kiß╗ćn ß╗®ng vß╗øi ├Īp suß║źt 1 bar (vß╗øi chß║źt kh├Ł), nß╗ōng ─æß╗Ö 1 mol/L (─æß╗æi vß╗øi chß║źt tan trong dung dß╗ŗch) v├Ā nhiß╗ćt ─æß╗Ö thŲ░ß╗Øng ─æŲ░ß╗Żc chß╗Źn l├Ā 298 K.
B. ─Éiß╗üu kiß╗ćn chuß║®n l├Ā ─æiß╗üu kiß╗ćn ß╗®ng vß╗øi nhiß╗ćt ─æß╗Ö 298 K.
C. ├üp suß║źt 760 mmHg l├Ā ├Īp suß║źt ß╗¤ ─æiß╗üu kiß╗ćn chuß║®n.
D. ─Éiß╗üu kiß╗ćn chuß║®n l├Ā ─æiß╗üu kiß╗ćn ß╗®ng vß╗øi ├Īp suß║źt 1 atm, nhiß╗ćt ─æß╗Ö 0┬░C.
C├óu 24. Phß║Żn ß╗®ng luyß╗ćn gang trong l├▓ cao xß║Ży ra theo sŲĪ ─æß╗ō sau:
Fe2O3(s) + CO(g) ŌåÆ Fe(s) + CO2(g)
Tß╗½ 1 mol Fe2O3 v├Ā 1 mol CO, giß║Ż sß╗Ł chß╗ē xß║Ży ra phß║Żn ß╗®ng theo sŲĪ ─æß╗ō tr├¬n vß╗øi hiß╗ću suß║źt 100% th├¼ giß║Żi ph├│ng mß╗Öt lŲ░ß╗Żng nhiß╗ćt l├Ā (Biß║┐t nhiß╗ćt tß║Īo th├Ānh chuß║®n cß╗¦a Fe2O3; CO; Fe; CO2 (kJ/ mol) lß║¦n lŲ░ß╗Żt l├Ā ŌĆō824,2; ŌĆō110,5; 0 v├Ā ŌĆō393,5)
A. 8,27 kJ.
B. 49,6 kJ.
C. 12,4 kJ.
D. 74,4 kJ.
C├óu 25. Cho phß║Żn ß╗®ng h├│a hß╗Źc sau: CH4(g) + Cl2(g) ŌåÆ CH3Cl(g) + HCl(g). Biß║┐n thi├¬n enthalpy chuß║®n cß╗¦a phß║Żn ß╗®ng n├Āy ─æŲ░ß╗Żc t├Łnh theo c├┤ng thß╗®c l├Ā
A. \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{0}}\text{=}\,\text{1}\text{.}{{\text{E}}_{\text{b}}}\text{(C}{{\text{H}}_{\text{4}}}\text{)+1}\text{.}{{\text{E}}_{\text{b}}}\text{(C}{{\text{l}}_{\text{2}}}\text{)-1}\text{.}{{\text{E}}_{\text{b}}}\text{(C}{{\text{H}}_{\text{3}}}\text{Cl)-1}\text{.}{{\text{E}}_{\text{b}}}\text{(HCl)}\)
B. \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{0}}\text{=}\,\text{1}\text{.}{{\text{E}}_{\text{b}}}\text{(C}{{\text{H}}_{\text{4}}}\text{)+1}\text{.}{{\text{E}}_{\text{b}}}\text{(C}{{\text{l}}_{\text{2}}}\text{)+1}\text{.}{{\text{E}}_{\text{b}}}\text{(C}{{\text{H}}_{\text{3}}}\text{Cl)+1}\text{.}{{\text{E}}_{\text{b}}}\text{(HCl)}\)
C. \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{0}}\text{=}\,\text{1}\text{.}{{\text{E}}_{\text{b}}}\text{(C}{{\text{H}}_{\text{3}}}\text{Cl)+1}\text{.}{{\text{E}}_{\text{b}}}\text{(HCl)-1}\text{.}{{\text{E}}_{\text{b}}}\text{(C}{{\text{H}}_{\text{4}}}\text{)+1}\text{.}{{\text{E}}_{\text{b}}}\text{(C}{{\text{l}}_{\text{2}}}\text{)}\)
D. \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{0}}\text{=}\,\text{1}\text{.}{{\text{E}}_{\text{b}}}\text{(C}{{\text{H}}_{\text{3}}}\text{Cl)+1}\text{.}{{\text{E}}_{\text{b}}}\text{(HCl)-1}\text{.}{{\text{E}}_{\text{b}}}\text{(C}{{\text{H}}_{\text{4}}}\text{)-1}\text{.}{{\text{E}}_{\text{b}}}\text{(C}{{\text{l}}_{\text{2}}}\text{)}\)
PHß║”N II: Tß╗░ LUß║¼N (3 ─ÉIß╗éM)
C├óu 1 (1,5 ─æiß╗ām): Trong ph├▓ng th├Ł nghiß╗ćm, kh├Ł chlorine c├│ thß╗ā ─æŲ░ß╗Żc ─æiß╗üu chß║┐ bß║▒ng c├Īch cho MnO2 t├Īc dß╗źng vß╗øi HCl ─æß║Ęc, ─æun n├│ng. Phß║Żn ß╗®ng ho├Ī hß╗Źc xß║Ży ra theo sŲĪ ─æß╗ō sau:
MnO2 + HCl ŌåÆ MnCl2 + Cl2 + H2O
a) Lß║Łp phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc cß╗¦a phß║Żn ß╗®ng theo phŲ░ŲĪng ph├Īp th─āng bß║▒ng electron v├Ā chß╗ē r├Ą chß║źt khß╗Ł, chß║źt oxi ho├Ī.
b) Giß║Ż sß╗Ł hiß╗ću suß║źt phß║Żn ß╗®ng ─æß║Īt 100%. T├Łnh khß╗æi lŲ░ß╗Żng MnO2 cß║¦n d├╣ng ─æß╗ā thu ─æŲ░ß╗Żc 2,479 l├Łt kh├Ł Cl2 ß╗¤ ─æiß╗üu kiß╗ćn chuß║®n.
C├óu 2 (0,5 ─æiß╗ām): Cho phß║Żn ß╗®ng sau:
Fe2O3 (s) + 3CO (g) ŌåÆ 2Fe (s) + 3CO2 (g) \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{0}}\text{=}\,\text{-24,74}\,\text{kJ}\)
Vß║Į sŲĪ ─æß╗ō biß╗āu diß╗ģn biß║┐n thi├¬n enthalpy cß╗¦a phß║Żn ß╗®ng.
HŲ»ß╗ÜNG Dß║¬N GIß║óI
PHß║”N I: TRß║«C NGHIß╗åM (7 ─ÉIß╗éM)
|
1 ŌĆō C |
2 ŌĆō C |
3 ŌĆō A |
4 ŌĆō C |
5 ŌĆō D |
6 ŌĆō D |
7 ŌĆō B |
8 ŌĆō A |
9 ŌĆō B |
10 ŌĆō A |
|
11 ŌĆō A |
12 ŌĆō B |
13 ŌĆō B |
14 ŌĆō C |
15 ŌĆō B |
16 ŌĆō C |
17 ŌĆō B |
18 ŌĆō D |
19 ŌĆō D |
20 ŌĆō D |
|
21 ŌĆō A |
22 ŌĆō C |
23 ŌĆō A |
24 ŌĆō A |
25 ŌĆō A |
26 ŌĆō D |
27 ŌĆō C |
28 ŌĆō B |
|
|
Câu 9.
2NH3 + 3CuO ŌåÆ 3Cu + N2+ 3H2O
Tß╗Ģng hß╗ć sß╗æ c├ón bß║▒ng (tß╗æi giß║Żn) cß╗¦a phß║Żn ß╗®ng l├Ā: 2 + 3 + 3 + 1 + 3 = 12.
Câu 12.
Cu + 2H2SO4 (─æß║Ęc) ŌåÆ H2SO4 + SO2 + 2H2O
Theo PTHH c├│:
nSO2=nCu=6,464=0,1(mol)
Vß║Ły V = 0,1 ├Ś 24,79 = 2,479 (l├Łt).
Câu 14.
2Al + 6H2SO4 ŌåÆ Al2(SO4)3 + 3SO2 + 6H2O
Vß║Ły tß╗ē lß╗ć a : b = 2 : 6 = 1 : 3.
Câu 15.
Phß║Żn ß╗®ng toß║Ż nhiß╗ćt: (b) v├Ā (d).
Câu 21.
CaCO3(s) ŌåÆ CaO(g) + CO2(g)
\({{\Delta }_{r}}H_{298}^{o}=\text{ }\left( -635 \right)\text{ }+\text{ }\left( -393,5 \right)\text{ }\text{ }\left( -1207 \right)\text{ }=\text{ }+178,5\text{ }\left( kJ \right).\)
Câu 22.
Ph├Īt biß╗āu ─æ├║ng l├Ā: (a), (b), (d).
Câu 24.
PhŲ░ŲĪng tr├¼nh h├│a hß╗Źc: Fe2O3(s) + 3CO(g) ŌåÆ 2Fe(s) + 3CO2(g)
Biß║┐n thi├¬n enthalpy chuß║®n cß╗¦a phß║Żn ß╗®ng:
\[{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{0}}\text{=}\,\text{3}\text{.}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{0}}\text{(C}{{\text{O}}_{\text{2}}}\text{(g))+2}\text{.}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{0}}\text{(Fe(s))-3}\text{.}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{0}}\text{(CO(g))-}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{0}}\text{(F}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{3}}}\text{(s))}\]
= 3.(ŌłÆ393,5) +2.0 ŌłÆ 3.(ŌłÆ110,5) ŌĆō (ŌłÆ824,2) = ŌłÆ24,8 kJ
Theo phŲ░ŲĪng tr├¼nh h├│a hß╗Źc ta c├│ CO hß║┐t, Fe2O3 dŲ░, t├Łnh to├Īn theo mol CO.
Tß╗½ 1 mol Fe2O3 v├Ā 1 mol CO, giß║Ż sß╗Ł chß╗ē xß║Ży ra phß║Żn ß╗®ng (1) vß╗øi hiß╗ću suß║źt 100% th├¼ giß║Żi ph├│ng mß╗Öt lŲ░ß╗Żng nhiß╗ćt l├Ā 24,83=8,27(kJ).24,8/3=8,27(kJ).
Câu 26.
Biß║┐n thi├¬n enthalpy chuß║®n cß╗¦a phß║Żn ß╗®ng l├Ā:
\[{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{0}}\text{=}{{\text{E}}_{\text{b(H-H)}}}\text{+}{{\text{E}}_{\text{b(Cl-Cl)}}}\text{-2}{{\text{E}}_{\text{b(H-Cl)}}}\text{=436+243-2}\text{.432=-185(kJ)}\text{.}\]
PHß║”N II: Tß╗░ LUß║¼N (3 ─ÉIß╗éM)
Câu 1.
a) \[\overset{\text{+4}}{\mathop{\text{Mn}}}\,{{\text{O}}_{\text{2}}}\text{+ }\!\!~\!\!\text{ H}\overset{\text{-1}}{\mathop{\text{Cl}}}\,\to \overset{\text{+2}}{\mathop{\text{Mn}}}\,\text{C}{{\text{l}}_{\text{2}}}\text{+ }\!\!~\!\!\text{ }{{\overset{\text{0}}{\mathop{\text{Cl}}}\,}_{\text{2}}}\text{+ }\!\!~\!\!\text{ }{{\text{H}}_{\text{2}}}\text{O}\]
Chß║źt khß╗Ł: HCl; chß║źt oxi ho├Ī: MnO2.
Ta c├│ c├Īc qu├Ī tr├¼nh:
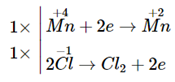
PhŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc:
MnO2 + 4HCl ŌåÆ MnCl2 + Cl2 + 2H2O
b) Theo phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc ta c├│:
\[\text{nMn}{{\text{O}}_{\text{2}}}\text{=nC}{{\text{l}}_{\text{2}}}\text{=}\frac{\text{2,479}}{\text{24,79}}\text{=0,1mol}\text{.}\]
Khß╗æi lŲ░ß╗Żng MnO2 cß║¦n d├╣ng l├Ā: 0,1.87 = 8,7 (gam).
─Éß╗Ć Sß╗É 2
PHß║”N I: TRß║«C NGHIß╗åM (7 ─ÉIß╗éM)
C├óu 1. Ph├Īt biß╗āu n├Āo sau ─æ├óy kh├┤ng ─æ├║ng?
A. Trong mß╗Öt ph├ón tß╗Ł, tß╗Ģng sß╗æ oxi ho├Ī cß╗¦a c├Īc nguy├¬n tß╗Ł bß║▒ng 0.
B. Trong hß╗Żp chß║źt, oxygen c├│ sß╗æ oxi h├│a bß║▒ng -2, trß╗½ mß╗Öt sß╗æ trŲ░ß╗Øng hß╗Żp ngoß║Īi lß╗ć.
C. Sß╗æ oxi h├│a cß╗¦a hydrogen trong c├Īc hydride kim loß║Īi bß║▒ng +1.
D. C├Īc nguy├¬n tß╗æ phi kim c├│ sß╗æ oxi h├│a thay ─æß╗Ģi t├╣y thuß╗Öc v├Āo hß╗Żp chß║źt chß╗®a ch├║ng.
C├óu 2. Sß╗æ oxi ho├Ī cß╗¦a chlorine trong hß╗Żp chß║źt HClO l├Ā
A. +1.
B. -1.
C. +3.
D. +2.
C├óu 3. Sß╗æ oxi ho├Ī cß╗¦a sulfur trong hß╗Żp chß║źt \(SO_{3}^{2-}\) l├Ā:
A. +2.
B. +4.
C. +6.
D. -2.
C├óu 4. Chß║źt n├Āo sau ─æ├óy c├│ t├Łnh khß╗Ł mß║Īnh?
A. KMnO4.
B. F2.
C. H2S.
D. CrO3.
C├óu 5. Cho c├Īc hß╗Żp chß║źt sau: NH3; NH4Cl; NaNO3; HNO3; N2O5. Sß╗æ hß╗Żp chß║źt trong ─æ├│ nitrogen c├│ sß╗æ oxi ho├Ī -3 l├Ā
A. 1.
B. 2.
C. 3.
D. 4.
C├óu 6. Cho c├Īc phß║Żn ß╗®ng h├│a hß╗Źc sau:
(a) CaO+CO2 ŌåÆ CaCO3
(b) 2CH4 ŌåÆ C2H2 + 3H2
(c) 2Al(OH)3 ŌåÆ Al2O3+3H2O
(d) 2NaHCO3 ŌåÆ Na2CO3+CO2+H2O
Sß╗æ phß║Żn ß╗®ng oxi h├│a ŌĆō khß╗Ł l├Ā
A. 4.
B. 2.
C. 3.
D. 1.
C├óu 7. Phß║Żn ß╗®ng oxi h├│a ŌĆō khß╗Ł l├Ā phß║Żn ß╗®ng c├│ sß╗▒ chuyß╗ān dß╗ŗch
A. electron giß╗»a c├Īc chß║źt.
B. neutron giß╗»a c├Īc chß║źt.
C. proton cß╗¦a nguy├¬n tß╗Ł.
D. cation.
C├óu 8. Cho phß║Żn ß╗®ng: SO2 + Br2 + 2H2O ŌåÆ 2HBr + H2SO4. Trong phß║Żn ß╗®ng tr├¬n, vai tr├▓ cß╗¦a SO2 l├Ā
A. chß║źt khß╗Ł.
B. chß║źt oxi h├│a.
C. vß╗½a l├Ā chß║źt oxi h├│a, vß╗½a l├Ā chß║źt tß║Īo m├┤i trŲ░ß╗Øng.
D. vß╗½a l├Ā chß║źt khß╗Ł, vß╗½a l├Ā chß║źt tß║Īo m├┤i trŲ░ß╗Øng.
C├óu 9. Trong phß║Żn ß╗®ng n├Āo sau ─æ├óy HCl ─æ├│ng vai tr├▓ l├Ā chß║źt oxi ho├Ī?
A. 8HCl + Fe3O4 ŌåÆ FeCl2 + 2FeCl3 + 4H2O.
B. 2HCl + Na2CO3 ŌåÆ 2NaCl + CO2 + H2O.
C. 16HCl + 2KMnO4 ŌåÆ 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
D. 2HCl + Fe ŌåÆ FeCl2 + H2.
C├óu 10. Cho 4,2 gam Fe phß║Żn ß╗®ng ho├Ān to├Ān vß╗øi lŲ░ß╗Żng dŲ░ dung dß╗ŗch HNO3, thß╗ā t├Łch kh├Ł NO (─ækc) bay ra l├Ā (coi NO l├Ā sß║Żn phß║®m khß╗Ł duy nhß║źt)
A. 1,8593 l├Łt.
B. 3,3600 l├Łt.
C. 3,7185 l├Łt .
D. 5,6360 l├Łt.
C├óu 11. Cho phß║Żn ß╗®ng ho├Ī hß╗Źc sau: Al + HNO3 ŌåÆ Al(NO3)3 + NO + H2O. Hß╗ć sß╗æ c├ón bß║▒ng (l├Ā sß╗æ nguy├¬n, tß╗æi giß║Żn) cß╗¦a c├Īc chß║źt trong sß║Żn phß║®m lß║¦n lŲ░ß╗Żt l├Ā
A. 1, 1, 2.
B. 8, 3, 9.
C. 2, 2, 5.
D. 2, 1, 4.
C├óu 12. Trong phß║Żn ß╗®ng: Cu + 4HNO3 ŌåÆ Cu(NO3)2 + 2NO2 + 2H2O. Sß╗æ ph├ón tß╗Ł nitric acid (HNO3) ─æ├│ng vai tr├▓ chß║źt oxi h├│a l├Ā
A. 8.
B. 6.
C. 4.
D. 2.
C├óu 13. Tr├¬n thß║┐ giß╗øi, zinc (kß║Įm) ─æŲ░ß╗Żc sß║Żn xuß║źt chß╗¦ yß║┐u tß╗½ quß║Ęng zinc blende c├│ th├Ānh phß║¦n ch├Łnh l├Ā ZnS. ß╗× giai ─æoß║Īn ─æß║¦u cß╗¦a qu├Ī tr├¼nh sß║Żn xuß║źt, quß║Ęng zinc blende ─æŲ░ß╗Żc nung trong kh├┤ng kh├Ł ─æß╗ā thß╗▒c hiß╗ćn phß║Żn ß╗®ng:
ZnS + O2 ŌåÆ ZnO + SO2
Tß╗Ģng hß╗ć sß╗æ c├ón bß║▒ng (l├Ā c├Īc sß╗æ nguy├¬n, tß╗æi giß║Żn) cß╗¦a chß║źt tham gia trong phß║Żn ß╗®ng l├Ā
A. 4.
B. 5.
C. 6.
D. 7.
C├óu 14. Dß║½n kh├Ł SO2 v├Āo 10 mL dung dß╗ŗch KMnO4 0,02M ─æß║┐n khi dung dß╗ŗch vß╗½a mß║źt m├Āu t├Łm. Phß║Żn ß╗®ng xß║Ży ra theo sŲĪ ─æß╗ō sau:
SO2 + KMnO4 + H2O ŌåÆ H2SO4 + K2SO4 + MnSO4
Thß╗ā t├Łch kh├Ł SO2 ─æ├Ż tham gia phß║Żn ß╗®ng ß╗¤ ─æiß╗üu kiß╗ćn chuß║®n l├Ā
A. 12,395 l├Łt.
B. 12,395 mL.
C. 123,95 mL.
D. 123,95 l├Łt.
C├óu 15. Enthalpy tß║Īo th├Ānh chuß║®n (hay nhiß╗ćt tß║Īo th├Ānh chuß║®n) cß╗¦a mß╗Öt chß║źt, k├Ł hiß╗ću l├Ā
A. \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{0}}\text{.}\)
B. \({{\text{ }\!\!\Delta\!\!\text{ }}_{_{f}}}\text{H}_{\text{298}}^{\text{0}}\text{.}\)
C. \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{s}}}\text{H}_{\text{298}}^{\text{0}}\text{.}\)
D. \({{\text{ }\!\!\Delta\!\!\text{ }}_{_{f}}}\text{H}_{0}^{298}\text{.}\)
C├óu 16. Ph├Īt biß╗āu n├Āo sau ─æ├óy kh├┤ng ─æ├║ng?
A. C├Īc phß║Żn ß╗®ng ch├Īy thŲ░ß╗Øng l├Ā phß║Żn ß╗®ng tß╗Åa nhiß╗ćt.
B. Phß║Żn ß╗®ng c├Āng tß╗Åa ra nhiß╗üu nhiß╗ćt c├Āng dß╗ģ tß╗▒ xß║Ży ra.
C. C├Īc phß║Żn ß╗®ng ph├ón hß╗¦y thŲ░ß╗Øng l├Ā phß║Żn ß╗®ng thu nhiß╗ćt.
D. C├Īc phß║Żn ß╗®ng khi ─æun n├│ng ─æß╗üu dß╗ģ xß║Ży ra hŲĪn.
C├óu 17. Cho phß║Żn ß╗®ng sau:
C(s) + O2(g) ŌåÆ CO2(g) \[{{\Delta }_{r}}H_{298}^{0}=-393,5kJ\]
Nhiß╗ćt tß║Īo th├Ānh chuß║®n cß╗¦a CO2(g) l├Ā
A. 393,5 kJ/ mol.
B. ŌĆō 393,5 kJ/ mol.
C. 39,35 kJ/ mol.
D. ŌĆō 39,35 kJ/ mol.
C├óu 18. Cho c├Īc phß║Żn ß╗®ng sau:
(1) H2(g) + Cl2(g) ŌåÆ 2HCl (g) \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{0}}\text{=-184,6}\,\text{kJ}\)
(2) CH4(g) + H2O(l) ŌåÆ CO(g) + 3H2(g) \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{0}}\text{=}\,\text{249,9}\,\text{kJ}\)
Ph├Īt biß╗āu ─æ├║ng l├Ā
A. Cß║Ż hai phß║Żn ß╗®ng ─æß╗üu toß║Ż nhiß╗ćt.
B. Cß║Ż hai phß║Żn ß╗®ng ─æß╗üu thu nhiß╗ćt.
C. Phß║Żn ß╗®ng (1) toß║Ż nhiß╗ćt, phß║Żn ß╗®ng (2) thu nhiß╗ćt.
D. Phß║Żn ß╗®ng (2) thu nhiß╗ćt, phß║Żn ß╗®ng (1) toß║Ż nhiß╗ćt.
C├óu 19. Cho c├Īc ph├Īt biß╗āu sau:
(a). Trong ph├▓ng th├Ł nghiß╗ćm, c├│ thß╗ā nhß║Łn biß║┐t mß╗Öt phß║Żn ß╗®ng thu nhiß╗ćt hoß║Ęc toß║Ż nhiß╗ćt bß║▒ng c├Īch ─æo nhiß╗ćt ─æß╗Ö cß╗¦a phß║Żn ß╗®ng bß║▒ng mß╗Öt nhiß╗ćt kß║┐.
(b). Nhiß╗ćt ─æß╗Ö cß╗¦a hß╗ć phß║Żn ß╗®ng sß║Į t─āng l├¬n nß║┐u phß║Żn ß╗®ng thu nhiß╗ćt.
(c). Nhiß╗ćt ─æß╗Ö cß╗¦a hß╗ć phß║Żn ß╗®ng sß║Į t─āng l├¬n nß║┐u phß║Żn ß╗®ng toß║Ż nhiß╗ćt.
(d). Nhiß╗ćt ─æß╗Ö cß╗¦a hß╗ć phß║Żn ß╗®ng sß║Į giß║Żm ─æi nß║┐u phß║Żn ß╗®ng toß║Ż nhiß╗ćt.
(e). Nhiß╗ćt ─æß╗Ö cß╗¦a hß╗ć phß║Żn ß╗®ng sß║Į giß║Żm ─æi nß║┐u phß║Żn ß╗®ng thu nhiß╗ćt.
Sß╗æ ph├Īt biß╗āu kh├┤ng ─æ├║ng l├Ā
A. 1.
B. 2.
C. 3.
D. 4.
C├óu 20. Biß║┐t rß║▒ng ß╗¤ ─æiß╗üu kiß╗ćn chuß║®n, 1 mol ethanol ch├Īy tß╗Åa ra mß╗Öt nhiß╗ćt lŲ░ß╗Żng l├Ā 1,37 ├Ś 103 kJ. Nß║┐u ─æß╗æt ch├Īy ho├Ān to├Ān 15,1 gam ethanol, n─āng ─æŲ░ß╗Żc ─æŲ░ß╗Żc giß║Żi ph├│ng ra dŲ░ß╗øi dß║Īng nhiß╗ćt bß╗¤i phß║Żn ß╗®ng l├Ā
A. 0,450 kJ.
B. 2,25 ├Ś 103 kJ.
C. 4,50 ├Ś 102 kJ.
D. 1,37 ├Ś 103 kJ.
C├óu 21. PhŲ░ŲĪng tr├¼nh nhiß╗ćt hß╗Źc cß╗¦a phß║Żn ß╗®ng nhiß╗ćt ph├ón ho├Ān to├Ān 1 mol Cu(OH)2 ß╗¤ ─æiß╗üu kiß╗ćn chuß║®n, tß║Īo th├Ānh 1 mol CuO v├Ā 1 mol H2O, thu v├Āo nhiß╗ćt lŲ░ß╗Żng 9,0 kJ l├Ā
A. Cu(OH)2(s) ŌåÆ CuO(s) + H2O(l);
B. Cu(OH)2(s) ŌåÆ CuO(s) + H2O(l);
C. CuO(s) + H2O(l) ŌåÆ Cu(OH)2(s);
D. CuO(s) + H2O(l) ŌåÆ Cu(OH)2(s);
C├óu 22. Cho phß║Żn ß╗®ng sau:
SO2(g) + ┬Į O2(g) ŌåÆ SO3(l)
Biß║┐n thi├¬n enthalpy chuß║®n cß╗¦a phß║Żn ß╗®ng t├Łnh theo nhiß╗ćt tß║Īo th├Ānh l├Ā
A. \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{298}^{{}^\circ }={{\Delta }_{\text{f}}}\text{H}_{298}^{{}^\circ }\left( \text{S}{{\text{O}}_{3}}(\text{l}) \right)\text{-}\left[ {{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{ }\!\!{}^\circ\!\!\text{ }}\left( \text{S}{{\text{O}}_{\text{2}}}\text{( }\!\!~\!\!\text{ g)} \right)\text{+}\frac{\text{1}}{\text{2}}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{ }\!\!{}^\circ\!\!\text{ }}\left( {{\text{O}}_{\text{2}}}\text{( }\!\!~\!\!\text{ g)} \right) \right].\)
B. \({{\Delta }_{r}}\text{H}_{298}^{{}^\circ }={{\Delta }_{\text{f}}}\text{H}_{298}^{{}^\circ }\left( \text{S}{{\text{O}}_{3}}(\text{l}) \right)-{{\Delta }_{\text{f}}}\text{H}_{298}^{{}^\circ }\left( \text{S}{{\text{O}}_{2}}(~\text{g}) \right)+\frac{1}{2}{{\Delta }_{\text{f}}}\text{H}_{298}^{{}^\circ }\left( {{\text{O}}_{2}}(~\text{g}) \right).\)
C. \({{\Delta }_{\text{r}}}\text{H}_{2S8}^{{}^\circ }=\left[ {{\Delta }_{\text{f}}}\text{H}_{298}^{{}^\circ }\left( \text{S}{{\text{O}}_{2}}(~\text{g}) \right)+\frac{1}{2}{{\Delta }_{\text{f}}}\text{H}_{298}^{{}^\circ }\left( {{\text{O}}_{2}}(~\text{g}) \right) \right]-{{\Delta }_{\text{f}}}\text{H}_{298}^{{}^\circ }\left( \text{S}{{\text{O}}_{3}}(\text{l}) \right).\)
D. \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{298}^{{}^\circ }={{\Delta }_{\text{f}}}\text{H}_{\text{298}}^{\text{ }\!\!{}^\circ\!\!\text{ }}\left( \text{S}{{\text{O}}_{\text{3}}}\text{(l)} \right)\text{+}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{ }\!\!{}^\circ\!\!\text{ }}\left( \text{S}{{\text{O}}_{\text{2}}}\text{( }\!\!~\!\!\text{ g)} \right)\text{+}\frac{\text{1}}{\text{2}}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{ }\!\!{}^\circ\!\!\text{ }}\left( {{\text{O}}_{\text{2}}}\text{( }\!\!~\!\!\text{ g)} \right)\text{.}\)
C├óu 23. X├Īc ─æß╗ŗnh biß║┐n thi├¬n enthalpy chuß║®n cß╗¦a phß║Żn ß╗®ng:
C2H2(g) + 2H2(g) ŌåÆ C2H6(g)
Biß║┐t n─āng lŲ░ß╗Żng li├¬n kß║┐t (ß╗¤ ─æiß╗üu kiß╗ćn chuß║®n): Eb (HŌĆōH) = 436 kJ/mol; Eb (CŌĆōH) = 418 kJ/mol; Eb (CŌēĪC) = 837 kJ/mol.
A. +309 kJ.
B. ŌĆō309 kJ.
C. ŌĆō358 kJ.
D. +358 kJ.
C├óu 24. Ph├Īt biß╗āu n├Āo sau ─æ├óy kh├┤ng ─æ├║ng?
A. ─Éß╗ā so s├Īnh biß║┐n thi├¬n enthalpy cß╗¦a c├Īc phß║Żn ß╗®ng kh├Īc nhau th├¼ cß║¦n x├Īc ─æß╗ŗnh ch├║ng ß╗¤ c├╣ng mß╗Öt ─æiß╗üu kiß╗ćn.
B. Phß║Żn ß╗®ng h├│a hß╗Źc l├Ā qu├Ī tr├¼nh ph├Ī vß╗Ī c├Īc li├¬n kß║┐t trong chß║źt ─æß║¦u v├Ā h├¼nh th├Ānh c├Īc li├¬n kß║┐t mß╗øi ─æß╗ā tß║Īo th├Ānh sß║Żn phß║®m.
C. Sß╗▒ ph├Ī vß╗Ī li├¬n kß║┐t giß║Żi ph├│ng n─āng lŲ░ß╗Żng, trong khi sß╗▒ h├¼nh th├Ānh li├¬n kß║┐t lß║Īi cß║¦n cung cß║źp n─āng lŲ░ß╗Żng.
D. Khi than, cß╗¦i ch├Īy, kh├┤ng kh├Ł xung quanh ß║źm hŲĪn do phß║Żn ß╗®ng tß╗Åa nhiß╗ćt.
C├óu 25. Cho c├Īc phß║Żn ß╗®ng sau:
(1) Phß║Żn ß╗®ng t├┤i v├┤i: CaO + H2O ŌåÆ Ca(OH)2.
(2) Phß║Żn ß╗®ng trung ho├Ā acid ŌĆō base: HCl + NaOH ŌåÆ NaCl + H2O.
(3) Phß║Żn ß╗®ng nhiß╗ćt ph├ón potassium chlorate: 2KClO3 ŌåÆ 2KCl + 3O2.
Phß║Żn ß╗®ng toß║Ż nhiß╗ćt l├Ā
A. (1).
B. (2).
C. (3).
D. (1), (2).
C├óu 26. Cho phß║Żn ß╗®ng sau:
CO(g) + ┬Į O2(g) CO2(g)
Biß║┐n thi├¬n enthalpy cß╗¦a phß║Żn ß╗®ng ß╗¤ ─æiß╗üu kiß╗ćn chuß║®n l├Ā
(Biß║┐t nhiß╗ćt tß║Īo th├Ānh chuß║®n \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{0}}\) cß╗¦a CO2(g) l├Ā ŌĆō393,5 kJ/mol, cß╗¦a CO(g) l├Ā ŌĆō110,5 kJ/mol).
A. ŌĆō283 kJ.
B. +283 kJ.
C. ŌĆō316 kJ.
D. +316 kJ.
PHß║”N II: Tß╗░ LUß║¼N
C├óu 1 (1 ─æiß╗ām): Lß║Łp c├Īc phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc sau theo phŲ░ŲĪng ph├Īp th─āng bß║▒ng electron v├Ā chß╗ē r├Ą chß║źt khß╗Ł, chß║źt oxi ho├Ī, qu├Ī tr├¼nh oxi ho├Ī, qu├Ī tr├¼nh khß╗Ł.
a) CaO + C ŌåÆ CaC2 + CO.
b) C12H22O11+H2SO4 ŌåÆ CO2+SO2+H2O
C├óu 2 (1 ─æiß╗ām): Cho phß║Żn ß╗®ng sau:
C(graphite) + O2(g) ŌåÆ CO2(g) \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{0}}\text{(C}{{\text{O}}_{\text{2}}}\text{(g))}=\text{-393,50}\,\text{kJ/mol}\)
a) Cho biß║┐t ├Į ngh─®a cß╗¦a gi├Ī trß╗ŗ \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}_{\text{298}}^{\text{0}}\text{(C}{{\text{O}}_{\text{2}}}\text{(g))}\) .
b) Hß╗Żp chß║źt CO2(g) bß╗ün hŲĪn hay k├®m bß╗ün hŲĪn vß╗ü mß║Ęt n─āng lŲ░ß╗Żng so vß╗øi c├Īc ─æŲĪn chß║źt bß╗ün C(graphite) v├Ā O2(g).
HŲ»ß╗ÜNG Dß║¬N GIß║óI
PHß║”N I: TRß║«C NGHIß╗åM
|
1 - C |
2 - A |
3 - B |
4 - C |
5 - B |
6 - D |
7 - A |
8 - A |
9 - D |
10 - A |
|
11 - A |
12 - D |
13 - B |
14 - B |
15 - C |
16 - D |
17 - B |
18 - C |
19 - B |
20 - C |
|
21 - B |
22 - A |
23 - B |
24 - C |
25 - D |
26 - A |
27 - C |
28 - D |
Câu 10.
Fe + 4HNO3 ŌåÆ Fe(NO3)3 + NO + 2H2O
Theo phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc:
\({{n}_{NO}}={{n}_{Fe}}=\frac{4,2}{56}=0,075\,\left( mol \right).\)
Vß║Ły VNO = 0,075.24,79 = 1,8593 (l├Łt).
Câu 11.
Al + 4HNO3 ŌåÆ Al(NO3)3 + NO + 2H2O
Câu 31.
Cu + 4HNO3 ŌåÆ Cu(NO3)2 + 2NO2 + 2H2O
├× Cß╗® 4 ph├ón tß╗Ł HNO3 tham gia phß║Żn ß╗®ng th├¼ c├│ 2 ph├ón tß╗Ł ─æ├│ng vai tr├▓ l├Ā chß║źt oxi ho├Ī, 2 ph├ón tß╗Ł ─æ├│ng vai tr├▓ l├Ā m├┤i trŲ░ß╗Øng trong dung dß╗ŗch.
Câu 32.
Lß║Łp phŲ░ŲĪng tr├¼nh h├│a hß╗Źc cß╗¦a phß║Żn ß╗®ng theo phŲ░ŲĪng ph├Īp th─āng bß║▒ng electron:
\(\begin{matrix} 2\times & \overset{-2}{\mathop{S}}\,\to \overset{+4}{\mathop{S}}\,+6e \\ 3\times & {{\overset{0}{\mathop{O}}\,}_{2}}+4e\to \text{2}\overset{-2}{\mathop{\text{O}}}\, \\ \end{matrix} \)
2ZnS + 3O2 ŌåÆ 2ZnO + 2SO2
Tß╗Ģng hß╗ć sß╗æ cß╗¦a chß║źt tham gia l├Ā: 2 + 3 = 5.
Câu 14.
5SO2 + 2KMnO4 + 2H2O ŌåÆ 2H2SO4 + K2SO4 + 2MnSO4
Theo phŲ░ŲĪng tr├¼nh h├│a hß╗Źc ta c├│:
\({{\text{n}}_{\text{S}{{\text{O}}_{\text{2}}}}}=\frac{5}{2}{{\text{n}}_{\text{KMn}{{\text{O}}_{\text{4}}}}}=\frac{5}{2}.0,02.0,01=\text{0,0005}\,\text{(mol)}\)
VSO2 = 24,79.0,0005 = 0,012395 L = 12,395 (mL).
PHß║”N II: Tß╗░ LUß║¼N
Câu 1.
a) \(\text{CaO }\!\!~\!\!\text{ + }\!\!~\!\!\text{ }\overset{\text{0}}{\mathop{\text{C}}}\,~\xrightarrow{{{t}^{0}}}\text{Ca}{{\overset{\text{-1}}{\mathop{\text{C}}}\,}_{\text{2}}}\text{+ }\!\!~\!\!\text{ }\overset{\text{+2}}{\mathop{\text{C}}}\,\text{O}\)
Trong phß║Żn ß╗®ng C vß╗½a ─æ├│ng vai tr├▓ l├Ā chß║źt oxi ho├Ī, vß╗½a ─æ├│ng vai tr├▓ l├Ā chß║źt khß╗Ł.
Ta c├│ c├Īc qu├Ī tr├¼nh:
Qu├Ī tr├¼nh oxi h├│a: \(\overset{0}{\mathop{C}}\,\to \overset{+2}{\mathop{C}}\,+2e\)
Qu├Ī tr├¼nh khß╗Ł: \(\overset{0}{\mathop{C}}\,+1e\to \overset{-1}{\mathop{C}}\,\)
\(\begin{matrix} 1\times & \overset{0}{\mathop{C}}\,\to \overset{+2}{\mathop{C}}\,+2e \\ 1\times & \overset{0}{\mathop{C}}\,+2e\to 2\overset{-1}{\mathop{C}}\, \\ \end{matrix}\)
PhŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc:
CaO + 3C ŌåÆ CaC2 + CO
---(─Éß╗ā xem nß╗Öi dung ─æß║¦y ─æß╗¦ cß╗¦a to├Ān bß╗Ö ─æß╗ü thi v├Ā ─æ├Īp ├Īn, c├Īc em vui l├▓ng xem online hoß║Ęc ─æ─āng nhß║Łp ─æß╗ā tß║Żi vß╗ü m├Īy)---
Tr├¬n ─æ├óy l├Ā mß╗Öt phß║¦n tr├Łch ─æoß║Īn nß╗Öi dung Bß╗Ö 2 ─æß╗ü thi giß╗»a hß╗Źc k├¼ 2 m├┤n Ho├Ī 10 CTST n─ām hß╗Źc 2023 trŲ░ß╗Øng THPT Trß║¦n Ph├║ c├│ ─æ├Īp ├Īn. ─Éß╗ā xem th├¬m nhiß╗üu t├Āi liß╗ću tham khß║Żo hß╗»u ├Łch kh├Īc c├Īc em chß╗Źn chß╗®c n─āng xem online hoß║Ęc ─æ─āng nhß║Łp v├Āo trang hoc247.net ─æß╗ā tß║Żi t├Āi liß╗ću vß╗ü m├Īy t├Łnh.
Hy vß╗Źng t├Āi liß╗ću n├Āy sß║Į gi├║p c├Īc em hß╗Źc sinh ├┤n tß║Łp tß╗æt v├Ā ─æß║Īt th├Ānh t├Łch cao trong hß╗Źc tß║Łp.
Ch├║c c├Īc em hß╗Źc tß║Łp tß╗æt !
TŲ░ liß╗ću nß╗Ģi bß║Łt tuß║¦n
- Xem thêm







