Khoa học tự nhiên 7 Chân trời sáng tạo Bài 2 được HOC247 biên soạn tóm tắt nội dung bài Nguyên tử chương trình KHTN lớp 7. Nội dung tóm tắt lại các ý chính trong bài, giúp các em học sinh đến nắm chắc nội dung cần học. Đây cũng sẽ là tài liệu hay giúp cho việc dạy và học của quý thầy cô trong việc Khoa học tự nhiên 7 Chân trời sáng tạo Bài 2 và các em học sinh trở nên dễ dàng và hiệu quả hơn.
Tóm tắt lý thuyết
1.1. Mô hình nguyên tử Rutherford - Bohr
- Các chất đều được tạo nên từ những hạt vô cùng nhỏ, gọi là nguyên tử.
Ví dụ: Mỗi thanh thép chứa hàng tỉ tỉ nguyên tử iron (sắt)
- Theo Ernest Rutherford, nguyên tử có cấu tạo gồm:
+ Hạt nhân: ở bên trong mang điện tích dương
- Hạt nhân chứa các hạt proton (kí hiệu là p) mang điện tích dương, mỗi proton mang một đơn vị điện tích dương, quy ước là +1.
- Điện tích hạt nhân bằng tổng điện tích của các hạt proton trong nguyên tử, số đơn vị điện tích hạt nhân bằng số proton của nguyên tử.
Ví dụ: Nguyên tử nitrogen có 7p trong hạt nhân, điện tích hạt nhân của nitrogen là +7, số đơn vị diện tích hạt nhân là 7.
+ Vỏ: tạo bởi một hay nhiều electron (kí hiệu là e) mang điện tích âm. Mỗi electron mang một đơn vị điện tích âm, quy ước là -1.
+ Trong nguyên tử: số hạt proton = số hạt electron
Hình 2.4. Mô hình nguyên tử của Rutherford
- Dựa trên mô hình của Rutherford, Niels Bohr đã phát triển một mô hình hoàn chỉnh hơn để mô tả về nguyên tử.
+ Nguyên tử gồm các electron được sắp xếp thành từng lớp và chuyển động xung quanh hạt nhân theo quỹ đạo tương tự như hành tinh trong hệ Mặt Trời.
+ Các electron chuyển động rất nhanh xung quanh hạt nhân và phân bố theo từng lớp với số lượng electron nhất định trên mỗi lớp ở vỏ nguyên tử.
+ Lớp đầu tiên gần sát hạt nhân chứa tối đa 2 electron, lớp thứ hai chứa tối đa 8 electron,...Các electron được sắp xếp vào các lớp theo thứ tự từ trong ra ngoài cho đến hết.
Hình 2.5. Mô hình cấu tạo của một số nguyên tử (Mô hình của Rutherford – Bohr)
- Năm 1932, khi nghiên cứu sâu hơn về nguyên tử, James Chadwick phát hiện bên trong hạt nhân còn có một loại hạt không mang điện. Ông gọi chúng là neutron.
Hình 2.6. Mô hình nguyên tử oxygen (O)
1.2. Khối lượng nguyên tử
- Khối lượng nguyên tử bằng tổng khối lượng của các hạt proton, neutron, electron có trong nguyên tử.
- Khối lượng nguyên tử rất nhỏ, để biểu thị khối lượng nguyên tử, người ta sử dụng đơn vị khối lượng nguyên tử, viết tắt là amu (atomic mass unit).
1 amu = 1,6605.10-24 gam
- Proton và neutron có khối lượng xấp xỉ bằng nhau (gần bằng 1 amu). Electron có khối lượng rất bé (khoảng 0,00055 amu). Khối lượng hạt nhân được xem là khối lượng của nguyên tử.
Ví dụ:
- Nguyên tử hydrogen có 1 p trong hạt nhân nên khối lượng nguyên tử xấp xỉ là 1 amu.
- Nguyên tử carbon có 6 p và 6 n trong hạt nhân nên khối lượng nguyên tử xấp xỉ là 12 amu.
|
Bài tập minh họa
Bài 1: Mọi vật thể tự nhiên hay nhân tạo đều được tạo thành từ một số loại hạt vô cùng nhỏ bé gọi là nguyên tử. Vậy nguyên tử có cấu tạo như thế nào?
Hướng dẫn giải
- Cấu tạo của nguyên tử gồm: hạt nhân và vỏ
- Hạt nhân: mang điện tích dương
- Hạt proton (kí hiệu p) mang điện tích dương
- Neutron (kí hiệu n) không mang điện
- Vỏ: tạo bởi các electron (kí hiệu e) mang điện tích âm
Bài 2: Quan sát mô hình nguyên tử carbon và cho biết:
a) Số proton và số electron
b) Điện tích hạt nhân và số đơn vị điện tích hạt nhân
c) Số lớp electron và số electron trên mỗi lớp?
d) Xác định khối lượng nguyên tử carbon (biết số neutron bằng 6)
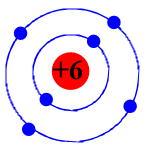
Mô hình nguyên tử carbon (C)
Hướng dẫn giải
a) Số p = số e = 6
b) Điện tích hạt nhân bằng +6. Số đơn vị điện tích hạt nhân bằng 6.
c) Có 2 lớp electron. Lớp 1 có 2 electron, lớp 2 có 4 electron.
d) Khối lượng hạt nhân được xem là khối lượng của nguyên tử.
Khối lượng của nguyên tử carbon: 6 + 6 = 12 (do khố lượng 1 p ≈ 1n ≈ 1 amu)
Bài 3: Nhôm (aluminium) là kim loại có nhiều ứng dụng trong thực tiễn, được dùng làm dây dẫn điện, chế tạo các thiết bị, máy móc trong công nghiệp và nhiều đồ dùng sinh hoạt. Cho biết tổng số hạt trong hạt nhân nguyên tử nhôm là 27, số đơn vị điện tích hạt nhân là 13. Tính số hạt mỗi loại trong nguyên tử nhôm và cho biết điện tích hạt nhân của nhôm?
Hướng dẫn giải
- Vì hạt nhân gồm có proton và neutron
→ Tổng số hạt trong hạt nhân = số proton + số neutron
→ 27 = số proton + số neutron
- Mà số đơn vị điện tích hạt nhân = số proton = 13 = số electron
→ Số neutron = 27 – 13 = 14
Vậy trong nguyên tử nhôm có: 13 hạt electron, 13 hạt proton, 14 hạt neutron
Luyện tập Bài 2 Khoa học tự nhiên 7 CTST
Học xong bài học này, em có thể:
- Trình bày được mô hình nguyên tử của Rutherford - Bohr (mô hình sắp xếp electron trong các lớp electron ở vỏ nguyên tử).
- Nêu được khối lượng của một nguyên tử theo đơn vị quốc tế amu (đơn vị khối lượng nguyên tử).
3.1. Trắc nghiệm Bài 2 Khoa học tự nhiên 7 CTST
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Khoa học tự nhiên 7 Chân trời sáng tạo Chủ đề 1 Bài 2 cực hay có đáp án và lời giải chi tiết.
-
- A. p và n
- B. n và e
- C. e và p
- D. n, p và e
-
Câu 2:
Hạt nhân được cấu tạo bởi:
- A. Neutron và electron
- B. Proton va electron
- C. Proton và neutron
- D. Electron
-
- A. Electron
- B. Electron và neutron
- C. Proton và neutron
- D. Electron và proton
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 2 Khoa học tự nhiên 7 CTST
Các em có thể xem thêm phần hướng dẫn Giải bài tập Khoa học tự nhiên 7 Chân trời sáng tạo Chủ đề 1 Bài 2 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Mở đầu trang 14 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Thảo luận 1 trang 14 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Thảo luận 2 trang 14 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Thảo luận 3 trang 15 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Thảo luận 4 trang 15 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Thảo luận 5 trang 16 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Thảo luận 6 trang 17 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Luyện tập trang 16 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Luyện tập trang 17 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 1 trang 17 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 2 trang 17 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 2.1 trang 6 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 2.2 trang 6 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 2.3 trang 6 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 2.4 trang 6 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 2.5 trang 6 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 2.6 trang 6 SBT Khoa học tự nhiên 7 Chân trời sáng tạo – CTST
Giải bài 2.7 trang 7 SBT Khoa học tự nhiên 7 Chân trời sáng tạo – CTST
Giải bài 2.8 trang 7 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 2.9 trang 7 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 2.10 trang 7 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 2.11 trang 7 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 2.12 trang 7 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Hỏi đáp Bài 2 Khoa học tự nhiên 7 CTST
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Khoa học tự nhiên HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!



.JPG)
.JPG)





