Hướng dẫn Giải bài tập Hóa học 11 CTST Bài 2 Cân bằng trong dung dịch nước môn Hóa học lớp 11 giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức.
-
Mở đầu trang 12 SGK Hóa học 11 Chân trời sáng tạo – CTST
Các hợp chất acid và base có vai trò rất quan trọng trong đời sống của con người. Acid, base là gì? Làm cách nào có thể xác định được nồng độ của dung dịch acid, base?

-
Thảo luận 1 trang 12 SGK Hóa học 11 Chân trời sáng tạo – CTST
Quan sát Hình 2.1, nhận xét hiện tượng xảy ra khi thực hiện thí nghiệm. So sánh tính dẫn điện của nước cất và các dung dịch.
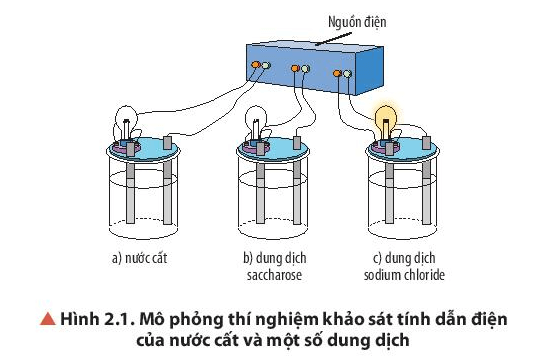
-
Thảo luận 2 trang 13 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hãy cho biết nguyên nhân vì sao dung dịch NaCl có tính dẫn điện.
-
Thảo luận 3 trang 13 SGK Hóa học 11 Chân trời sáng tạo – CTST
Quan sát Hình 2.3, nhận xét về độ sáng của bóng đèn ở các thí nghiệm. Biết rằng nồng độ mol của các dung dịch là bằng nhau, cho biết dung dịch nào dẫn điện mạnh, dẫn điện yếu và không dẫn điện.
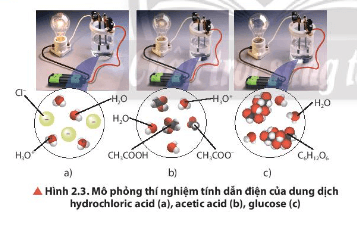
-
Thảo luận 4 trang 13 SGK Hóa học 11 Chân trời sáng tạo – CTST
Từ phương trình (1) và (2), nhận xét về mức độ phân li của HCl và CH3COOH trong nước.
-
Thảo luận 5 trang 14 SGK Hóa học 11 Chân trời sáng tạo – CTST
Nếu nhỏ thêm vài giọt dung dịch NaOH hoặc CH3COONa vào dung dịch CH3COOH thì cân bằng (2) chuyển dịch theo chiều nào?
-
Hoạt động 1 trang 14 SGK Hoá học 11 Chân trời sáng tạo – CTST
Viết phương trình điện li (nếu có) của các chất sau khi hoà tan vào nước: HNO3, Ca(OH)2 và BaCl2.
-
Thảo luận 6 trang 14 SGK Hóa học 11 Chân trời sáng tạo – CTST
Quan sát Hình 2.4 và Hình 2.5, cho biết chất nào nhận H+, chất nào cho H+.
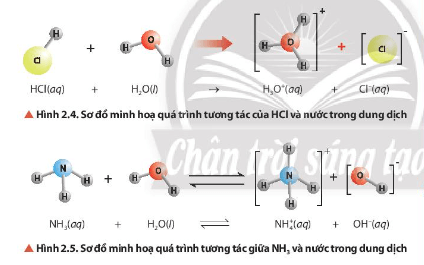
-
Thảo luận 7 trang 14 SGK Hóa học 11 Chân trời sáng tạo – CTST
Nhận xét về vai trò acid – base của phân tử H2O trong các cân bằng ở Hình 2.4, Hình 2.5 và cân bằng của ion HCO3- trong nước.
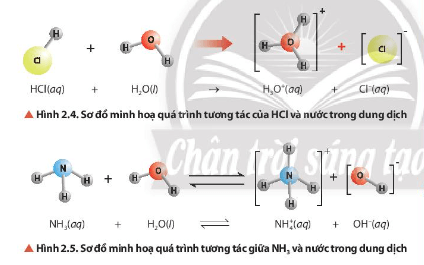
-
Hoạt động 2 trang 14 SGK Hoá học 11 Chân trời sáng tạo – CTST
Cho phương trình:
(1) CH3COOH + H2O ⇌ H3O+ + CH3COO-
(2) CO32- + H2O ⇌ HCO3- + OH-
Cho biết chất nào là acid, chất nào là base theo thuyết Bronsted – Lowry.
-
Thảo luận 8 trang 15 SGK Hóa học 11 Chân trời sáng tạo – CTST
Tính pH của dung dịch có nồng độ H+ là 10-2 M.
-
Thảo luận 9 trang 15 SGK Hóa học 11 Chân trời sáng tạo – CTST
Tính pH của dung dịch có nồng độ OH- là 10-4 M.
-
Thảo luận 10 trang 15 SGK Hóa học 11 Chân trời sáng tạo – CTST
Quan sát Hình 2.6, cho biết khoảng giá trị nào trong thang pH tương ứng với môi trường của dung dịch là acid, base hay trung tính.
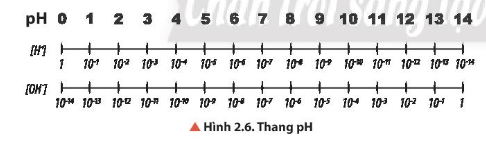
-
Hoạt động trang 15 SGK Hoá học 11 Chân trời sáng tạo – CTST
a) Pha 500 mL dung dịch HCl 0,2 M vào 500 mL nước. Tính pH của dung dịch thu được.
b) Tính khối lượng NaOH cần để pha 100 mL dung dịch NaOH có pH = 12.
-
Thảo luận 11 trang 16 SGK Hóa học 11 Chân trời sáng tạo – CTST
Quan sát Hình 2.7, cho biết khoảng pH thấp nhất và cao nhất ở các cơ quan trong hệ tiêu hoá của con người.
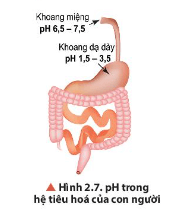
-
Vận dụng trang 16 SGK Hoá học 11 Chân trời sáng tạo – CTST
Đất chua là đất có độ pH dưới 6,5. Để cải thiện đất trồng bị chua, người nông dân có thể bổ sung chất nào trong các chất sau vào đất: CaO, P2O5? Giải thích.
-
Thảo luận 12 trang 16 SGK Hóa học 11 Chân trời sáng tạo – CTST
Quan sát Hình 2.8, trình bày sự chuyển đổi màu sắc của các chất chỉ thị acid – base trong các dung dịch có độ pH khác nhau.
-
Thảo luận 13 trang 17 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hãy nêu vai trò của chất chỉ thị trong phương pháp chuẩn độ acid – base.
-
Thảo luận 14 trang 17 SGK Hóa học 11 Chân trời sáng tạo – CTST
Quan sát Hình 2.9, giải thích vì sao cần lắc nhẹ dung dịch trong bình tam giác trong khi thực hiện thao tác chuẩn độ.
-
Thảo luận 15 trang 17 SGK Hóa học 11 Chân trời sáng tạo – CTST
Viết phương trình hoá học của phản ứng xảy ra trong thí nghiệm chuẩn độ dung dịch NaOH bằng dung dịch HCl.
-
Thảo luận 16 trang 18 SGK Hóa học 11 Chân trời sáng tạo – CTST
Quan sát Hình 2.10, mô tả hiện tượng ở thời điểm kết thúc chuẩn độ.
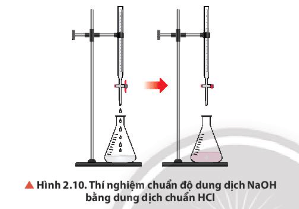
-
Thảo luận 17 trang 18 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giả sử khi kết thúc chuẩn độ, thể tích dung dịch NaOH đã sử dụng là 12,5 mL. Tính nồng độ của dung dịch NaOH ban đầu.
-
Thảo luận 18 trang 18 SGK Hóa học 11 Chân trời sáng tạo – CTST
Tại sao khi bảo quản dung dịch muối M3+ trong phòng thí nghiệm người ta thường nhỏ vài giọt dung dịch acid vào trong lọ đựng dung dịch muối.
-
Vận dụng 1 trang 19 SGK Hoá học 11 Chân trời sáng tạo – CTST
Ngoài tác dụng làm trong nước, dung dịch phèn chua còn có khả năng làm sạch gỉ sét trên inox. Giải thích.

-
Thảo luận 19 trang 18 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải thích vì sao quá trình thuỷ phân ion CO32- trong nước làm tăng pH của nước.
-
Vận dụng 2 trang 19 SGK Hoá học 11 Chân trời sáng tạo – CTST
Khi mưa nhiều ngày liên tục có thể làm cho pH của nước ở ao, hồ giảm xuống dưới 6,5 và người ta thường rắc vôi bột để điều chỉnh pH. Giải thích.
-
Giải Bài 1 trang 19 SGK Hóa học 11 Chân trời sáng tạo – CTST
Một dung dịch có [OH-] = 2,5 × 10-10 M. Tính pH và xác định môi trường của dung dịch này.
-
Giải Bài 2 trang 19 SGK Hóa học 11 Chân trời sáng tạo – CTST
Tính pH của dung dịch thu được sau khi trộn 40 mL dung dịch HCl 0,5 M với 60 mL dung dịch NaOH 0,5 M.
-
Giải Bài 3 trang 19 SGK Hóa học 11 Chân trời sáng tạo – CTST
Một mẫu dịch vị có pH = 2,5. Xác định nồng độ mol của ion H+ trong mẫu dịch vị đó.
-
Giải Bài 4 trang 19 SGK Hóa học 11 Chân trời sáng tạo – CTST
Viết phương trình điện li của các chất: H2SO4, Ba(OH)2, Al2(SO4)3.
-
Giải Bài 5 trang 19 SGK Hóa học 11 Chân trời sáng tạo – CTST
Ở các vùng quê, người dân thường dùng phèn chua để làm trong nước nhờ ứng dụng của phản ứng thuỷ phân ion Al3+. Giải thích. Chất hay ion nào là acid, là base trong phản ứng thuỷ phân Al3+?







