Các hợp chất acid và base có vai trò rất quan trọng trong đời sống của con người. Acid, base là gì? Làm cách nào có thể xác định nồng độ của dung dịch acid, base?
Mời các em cùng tìm hiểu câu trả lời thông qua nội dung lý thuyết và bài tập minh họa Bài 2: Cân bằng trong dung dịch nước môn Hóa học lớp 11 Chân Trời Sáng Tạo. Bài giảng gồm các nội dung chính về sự điện li, thuyết acid−base của Brønsted – Lowry, khái niệm pH và ý nghĩa của pH trong thực tiễn, sự thuỷ phân của các ion, chuẩn độ acid−base được HOC247 biên soạn, hi vọng sẽ giúp các em dễ dàng nắm được nội dung chính của bài.
Tóm tắt lý thuyết
1.1. Sự điện li, chất điện li, chất không điện li
a. Tìm hiểu hiện tượng điện li
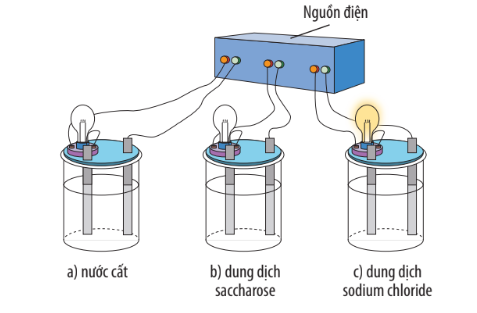
Hình 2.1. Mô phỏng thí nghiệm khảo sát tính dẫn điện của nước cất và một số dung dịch
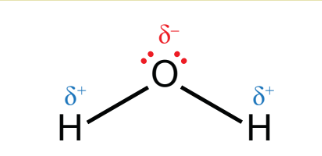
Hình 2.2. Cấu tạo của phân tử nước
– H2O là phân tử có cực.
– Khi cho NaCl tinh thể vào nước, xảy ra quá trình tương tác giữa các phân tử nước có cực và các ion của muối, kết hợp với sự chuyển động hỗn loạn không ngừng của các phân tử nước làm cho các ion Na và Cl của muối tách dần khỏi tinh thể và hoà tan vào nước, gọi là quá trình điện li hay sự điện li.
– NaCl được gọi là chất điện li, tan vào nước tạo ra ion và thu được dung dịch dẫn điện, gọi là dung dịch chất điện li.
– Sự điện li của NaCl trong nước có thể được biểu diễn bằng phương trình điện li như sau:
NaCl + (n + m)H2O→ Na+.nH2O + Cl-.mH2O
– Để đơn giản, người ta thường viết:
NaCl → Na+ + Cl-
| Quá trình phân li các chất trong nước tạo thành các ion được gọi là sự điện li. |
b. Tìm hiểu sự phân loại các chất điện li
%2C%20acetic%20acid%20(b)%2C%20glucose.png)
Hình 2.3. Mô phỏng thí nghiệm tính dẫn điện của dung dịch hydrochloric acid (a), acetic acid (b), glucose (c)
– Chất điện li mạnh bao gồm acid mạnh, base mạnh và hầu hết các muối tan.
– Trong phương trình điện li của chất điện li mạnh, người ta dùng một mũi tên chỉ chiều của quá trình điện li.
Ví dụ: HCl → H+ + Cl-
– Chất điện li yếu bao gồm các acid yếu, base yếu. Trong phương trình điện li của chất điện li yếu, người ta dùng hai nửa mũi tên ngược chiều nhau.
Ví dụ: CH3COOH \(\rightleftharpoons \) CH3COO- + H+
– Chất điện li mạnh là chất khi tan trong nước, các phân tử hoà tan đều phân li thành ion.
– Chất điện li yếu là chất khi tan trong nước chỉ có một số phân tử hoà tan phân li thành ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
– Chất không điện li là chất khi hoà tan vào trong nước, các phân tử không phân li thành ion.
1.2. Thuyết Brønsted – Lowry về acid – base
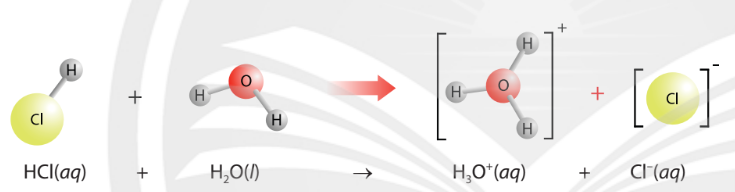
Hình 2.4. Sơ đồ minh hoạ quá trình tương tác của HCl và nước trong dung dịch
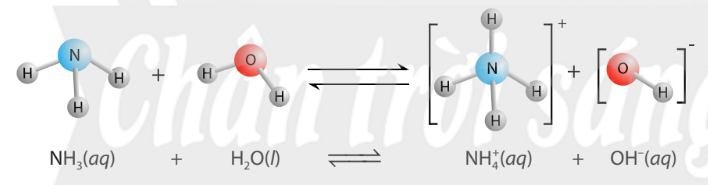
Hình 2.5. Sơ đồ minh hoạ quá trình tương tác giữa NH3 và nước trong dung dịch
Thuyết Brønsted – Lowry: Acid là chất cho proton (H+), base là chất nhận proton. Acid và base có thể là phân tử hoặc ion.
– Trong dung dịch NaHCO3 có các cân bằng sau:
HCO3- + H2O \(\rightleftharpoons \) H3O+ + CO32-
HCO3- + H2O \(\rightleftharpoons \) H2CO3 + OH-
– Ion HCO3- trong nước vừa có thể cho proton (H+), vừa có thể nhận proton nên gọi là chất lưỡng tính.
1.3. Khái niệm pH. Chất chỉ thị acid–base
a. Tìm hiểu khái niệm pH
Nước là chất điện li yếu:
H2O+H2O\(\rightleftharpoons \) H3O+ +OH-
hay viết đơn giản:
H2O \(\rightleftharpoons \) H+ + OH-
– Tích số nồng độ các ion H+ và OH- trong nước nguyên chất hoặc trong dung dịch nước có nồng độ chất tan không quá cao ở mỗi nhiệt độ là một hằng số, gọi là tích số ion của nước, kí hiệu Kw:
| Kw = [H+].[OH-] |
– Ở 25°C, Kw = [H+].[ OH-] = 10–14
+ Nước có môi trường trung tính nên có thể hiểu môi trường trung tính là môi trường trong đó [H] = [OH ] = 10–7 M.
+ Môi trường acid là môi trường trong đó [H+] > [OH-] hay [H+] > 10–7 M.
+ Môi trường base là môi trường trong đó [H+] < [OH-] hay [H+] < 10–7 M.
– Độ acid và độ kiềm của dung dịch có thể được đánh giá bằng nồng độ H+ hoặc quy về một giá trị gọi là pH với quy ước như sau:
| pH = -lg[H+] |
Nếu [H] = 10–a M thì pH = a
Trong đó, [H+] là nồng độ mol của ion H+ trong dung dịch.
– pH là chỉ số đánh giá độ acid hay độ base của một dung dịch.
– Thang pH thường dùng có giá trị từ 1 đến 14.
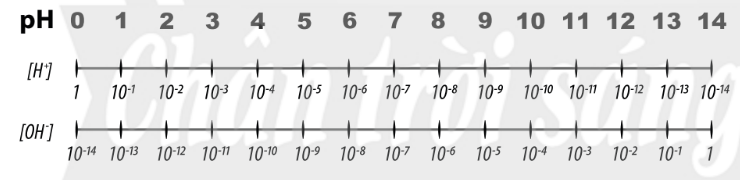
Hình 2.6. Thang pH
b. Tìm hiểu ý nghĩa của pH trong thực tiễn
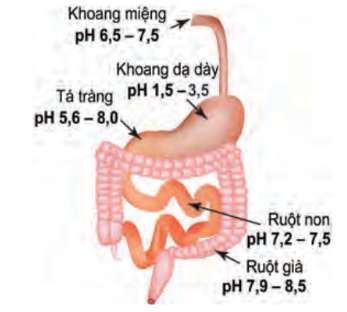
Hình 2.7. pH trong hệ tiêu hoá của con người
c. Tìm hiểu chất chỉ thị acid-base

%2C%20dung%20d%E1%BB%8Bch%20phenolphthalein%20(b)%2C%20gi%E1%BA%A5y%20qu%E1%BB%B3%20t%C3%ADm%20(c).png)
Hình 2.8. Sự thay đổi màu trong các môi trường đối với giấy pH (a), dung dịch phenolphthalein (b), giấy quỳ tím (c)
| Người ta có thể dùng máy đo pH để xác định giá trị pH của một dung dịch. |
1.4. Chuẩn độ acid–base
Tìm hiểu phương pháp chuẩn độ acid – base
Nguyên tắc:
– Chuẩn độ acid – base là phương pháp được sử dụng để xác định nồng độ dung dịch acid hoặc dung dịch base bằng dung dịch base hoặc dung dịch acid đã biết chính xác nồng độ (gọi là dung dịch chuẩn).
– Trong phương pháp này, người ta sử dụng dung dịch acid đã biết nồng độ làm dung dịch chuẩn để xác định nồng độ dung dịch base hoặc dùng dung dịch base đã biết nồng độ làm dung dịch chuẩn để xác định nồng độ dung dịch acid.
– Khi chuẩn độ, người ta thêm từ từ dung dịch đựng trong burette vào dung dịch đựng trong bình tam giác.
– Thời điểm mà hai chất tác dụng vừa đủ với nhau gọi là điểm tương đương.
– Để nhận biết điểm tương đương, người ta thường dùng những chất chỉ thị acid – base gây ra sự đổi màu ở khoảng pH gần với điểm tương đương.
Thao tác khi chuẩn độ: Tay thuận cầm bình tam giác, lắc nhẹ dung dịch trong bình, tay không thuận điều khiển khoá burette để thêm từ từ từng giọt dung dịch trên burette vào bình tam giác (Hình 2.9).

Hình 2.9. Thao tác chuẩn độ
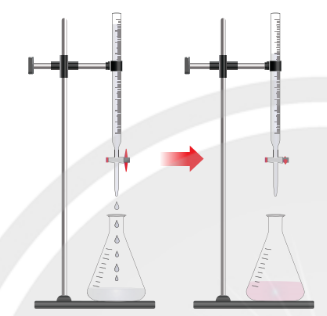
Hình 2.10. Thí nghiệm chuẩn độ dung dịch NaOH bằng dung dịch chuẩn HCl
Bài tập minh họa
Bài 1. Chọn câu trả lời đúng khi nói về muối acid
A. Dung dịch muối có pH < 7.
B. Muối có khả năng phản ứng với base.
C. Muối vẫn còn hydrogen trong phân tử.
D. Muối mà gốc acid vẫn còn hydrogen có khả năng phân li tạo proton trong nước.
Hướng dẫn giải
Muối acid là muối mà gốc acid vẫn còn hydrogen có khả năng phân li tạo proton trong nước.
⇒ Chọn D
Bài 2. Trong phương trình điện li của chất điện li mạnh
A. Dùng một mũi tên chỉ chiều của quá trình điện li
B. Dùng một mũi tên chỉ chiều của quá trình hòa tan
C. Dùng hai mũi tên chỉ chiều của quá trình điện li
D. Dùng hai mũi tên chỉ chiều của quá trình hòa tan
Hướng dẫn giải
Trong phương trình điện li của chất điện li mạnh dùng một mũi tên chỉ chiều của quá trình điện li.
⇒ Chọn A
Luyện tập Bài 2 Hóa 11 Chân Trời Sáng Tạo
Học xong bài học này, em có thể:
– Nêu được khái niệm sự điện li, chất điện li, chất không điện li; khái niệm và ý nghĩa của pH trong thực tiễn; nguyên tắc xác định nồng độ acid, base mạnh bằng phương pháp chuẩn độ.
– Trình bày được thuyết Brønsted – Lowry (Bron-stet – Lau-ri) về acid – base.
– Viết được biểu thức tính pH và biết cách sử dụng các chất chỉ thị để xác định pH (môi trường acid, base, trung tính) bằng các chất chỉ thị phổ biến.
– Trình bày được ý nghĩa thực tiễn cân bằng trong dung dịch nước của các ion.
3.1. Trắc nghiệm Bài 2 Hóa 11 Chân Trời Sáng Tạo
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 11 CTST Bài 2 cực hay có đáp án và lời giải chi tiết.
-
- A. Dung dịch muối có pH < 7.
- B. Muối có khả năng phản ứng với base.
- C. Muối vẫn còn hydrogen trong phân tử.
- D. Muối mà gốc acid vẫn còn hydrogen có khả năng phân li tạo proton trong nước.
-
- A. pH = lg[H+]
- B. pH + pOH = 14
- C. [H+].[OH-] = 10-14
- D. [H+] = 10-a thì pH = a
-
- A. gộp lại thành các ion
- B. phân li thành các ion
- C. phân li thành các nguyên tử
- D. Cả A, B, C
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 2 Hóa 11 Chân Trời Sáng Tạo
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 11 CTST Bài 2 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Mở đầu trang 12 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 1 trang 12 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 2 trang 13 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 3 trang 13 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 4 trang 13 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 5 trang 14 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hoạt động 1 trang 14 SGK Hoá học 11 Chân trời sáng tạo – CTST
Thảo luận 6 trang 14 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 7 trang 14 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hoạt động 2 trang 14 SGK Hoá học 11 Chân trời sáng tạo – CTST
Thảo luận 8 trang 15 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 9 trang 15 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 10 trang 15 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hoạt động trang 15 SGK Hoá học 11 Chân trời sáng tạo – CTST
Thảo luận 11 trang 16 SGK Hóa học 11 Chân trời sáng tạo – CTST
Vận dụng trang 16 SGK Hoá học 11 Chân trời sáng tạo – CTST
Thảo luận 12 trang 16 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 13 trang 17 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 14 trang 17 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 15 trang 17 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 16 trang 18 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 17 trang 18 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 18 trang 18 SGK Hóa học 11 Chân trời sáng tạo – CTST
Vận dụng 1 trang 19 SGK Hoá học 11 Chân trời sáng tạo – CTST
Thảo luận 19 trang 18 SGK Hóa học 11 Chân trời sáng tạo – CTST
Vận dụng 2 trang 19 SGK Hoá học 11 Chân trời sáng tạo – CTST
Giải Bài 1 trang 19 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 2 trang 19 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 3 trang 19 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 4 trang 19 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 5 trang 19 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hỏi đáp Bài 2 Hóa 11 Chân Trời Sáng Tạo
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!








