Trong các phản ứng hoá học, có một loại phản ứng trong đó các chất sản phẩm có khả năng phản ứng để tạo thành các chất đầu. Do vậy, phản ứng xảy ra không hoàn toàn và thường có hiệu suất không cao. Phản ứng tổng hợp ammonia từ nitrogen và hydrogen thuộc loại phản ứng này. Các phản ứng này được gọi là phản ứng gì? Để tăng hiệu suất của chúng, cần điều chỉnh những điều kiện phản ứng như nhiệt độ, áp suất, nồng độ, ... như thế nào?
Để giải đáp các câu hỏi đó, mời các em cùng tham khảo nội dung lý thuyết và bài tập minh họa Bài 1: Khái niệm về cân bằng hoá học môn Hóa học lớp 11 Chân Trời Sáng Tạo. Bài giảng đã được HOC247 biên soạn ngắn gọn, đầy đủ, dễ hiểu về cân bằng hoá học, phản ứng một chiều, phản ứng thuận nghịch, các yếu tố ảnh hưởng đến cân bằng hoá học và nguyên lí chuyển dịch cân bằng Le Chatelier giúp các em dễ dàng nắm được nội dung chính của bài.
Tóm tắt lý thuyết
1.1. Phản ứng một chiều, phản ứng thuận nghịch và cân bằng hoá học
a. Tìm hiểu khái niệm phản ứng một chiều
| Trong điều kiện xác định, phản ứng chỉ xảy ra theo chiều từ chất tham gia tạo thành sản phẩm mà sản phẩm không thể tác dụng với nhau để tạo lại chất ban đầu, gọi là phản ứng một chiều. Trong phương trình hoá học của phản ứng một chiều, người ta dùng kí hiệu mũi tên (→) chỉ chiều phản ứng. |
Ví dụ: 2KMnO4 \(\xrightarrow{{{t}^{0}}}\) K2MnO4 + MnO2 + O2
b. Tìm hiểu khái niệm phản ứng thuận nghịch
| Trong cùng điều kiện xác định, phản ứng xảy ra theo hai chiều trái ngược nhau được gọi là phản ứng thuận nghịch. Trong phương trình hoá học của phản ứng thuận nghịch người ta dùng kí hiệu hai nửa mũi tên ngược chiều ( \(\rightleftharpoons \) ): chiều từ trái sang phải là chiều thuận, chiều từ phải sang trái là chiều nghịch. |
Ví dụ: Cl2(g) + H2O(l) \(\rightleftharpoons \) HCl(aq) + HClO(aq)
c. Tìm hiểu khái niệm trạng thái cân bằng của phản ứng thuận nghịch
Cho phản ứng thuận nghịch sau trong điều kiện nhiệt độ, xúc tác và áp suất phù hợp:
N2(g) + 3H2(g) \(\rightleftharpoons \) NH3(g)
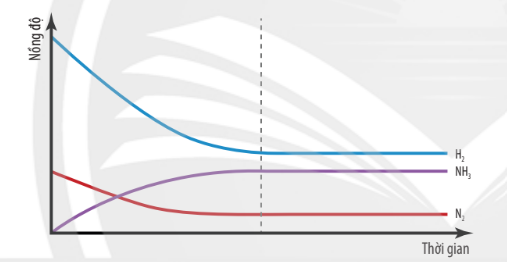
Hình 1.1. Đồ thị biểu diễn nồng độ các chất trong phản ứng theo thời gian
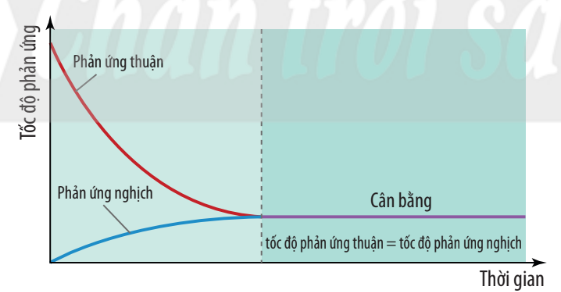
Hình 1.2. Đồ thị biểu diễn tốc độ phản ứng thuận và phản ứng nghịch theo thời gian
| Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái mà tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. |
1.2. Hằng số cân bằng của phản ứng thuận nghịch
a. Tìm hiểu hằng số cân bằng của phản ứng thuận nghịch
Xét hệ cân bằng sau: 2NO2(g) \(\rightleftharpoons \) N2O4(g)
(nâu đỏ) (không màu)
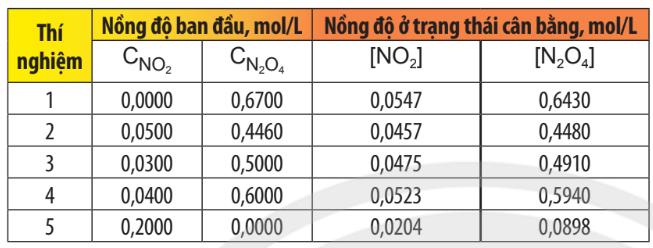
Bảng 1.1. Dữ liệu thực nghiệm về nồng độ các khí trước và sau khi hệ đạt trạng thái cân bằng ở 25°C
Tổng quát, nếu có phản ứng thuận nghịch sau: aA + bB \(\rightleftharpoons\) cC + dD
Khi phản ứng ở trạng thái cân bằng, ta có:
\({{K}_{C}}=\frac{\text{ }{{[\text{ C}]}^{\,c}}\ \text{ }{{[\text{ }\ D\ \text{ }]}^{\,d}}}{\text{ }{{[\text{ }A\text{ }]}^{\,a}}\text{ }{{[\text{ }B\text{ }]}^{\,b}}\text{ }}\)
– Trong đó [A], [B], [C] và [D] là nồng độ mol các chất A, B, C và D ở trạng thái cân bằng; a, b, c và d là hệ số tỉ lượng các chất trong phương trình hoá học.
– Chất rắn không xuất hiện trong biểu thức hằng số cân bằng.
– Trong phản ứng thuận nghịch, hằng số cân bằng Kc của phản ứng xác định chỉ phụ thuộc vào nhiệt độ.
– Trong phản ứng thuận nghịch thì hằng số cân bằng K là một đại lượng có ý nghĩa quan trọng, nó cho biết mức độ xảy ra của một phản ứng.
1.3. Sự chuyển dịch cân bằng hoá học
Thí nghiệm nghiên cứu ảnh hưởng của nhiệt độ tới chuyển dịch cân bằng hoá học
Thí nghiệm 1. Nghiên cứu sự chuyển dịch cân bằng của phản ứng
2NO2(g) \(\rightleftharpoons \) N2O4(g)
(nâu đỏ) (không màu)
Thí nghiệm 2. Nghiên cứu sự chuyển dịch cân bằng của phản ứng thuỷ phân sodium acetate

Hình 1.3. Thí nghiệm nghiên cứu ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng của phản ứng thuỷ phân sodium acetate
| Sự chuyển dịch cân bằng hoá học là sự dịch chuyển từ trạng thái cân bằng này sang trạng thái cân bằng khác. |
1.4. Các yếu tố ảnh hưởng đến cân bằng hoá học
| Những yếu tố làm chuyển dịch cân bằng thường là nồng độ, áp suất và nhiệt độ. Chúng được gọi là các yếu tố ảnh hưởng đến cân bằng hoá học. |
Nguyên lí Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó.
a. Tìm hiểu ảnh hưởng của nhiệt độ đến cân bằng hoá học
– Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ.
– Ngược lại, khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng toả nhiệt, chiều làm giảm tác động của việc giảm nhiệt độ.
b. Tìm hiểu ảnh hưởng của áp suất đến cân bằng hoá học
– Khi hệ đang ở trạng thái cân bằng, nếu tăng hoặc giảm áp suất của hệ, cân bằng chuyển dịch theo chiều làm giảm hoặc tăng áp suất của hệ.
– Khi hệ cân bằng có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau hoặc trong hệ không có chất khí, việc tăng hoặc giảm áp suất không làm chuyển dịch cân bằng của hệ.
c. Tìm hiểu ảnh hưởng của nồng độ đến cân bằng hoá học
– Nếu trong hệ cân bằng có chất rắn thì việc thêm hoặc bớt lượng chất rắn hầu như không ảnh hưởng đến trạng thái cân bằng của hệ, nghĩa là cân bằng không chuyển dịch.
– Khi tăng hoặc giảm nồng độ một chất trong cân bằng thì cân bằng chuyển dịch theo chiều làm giảm tác động của việc tăng hoặc giảm nồng độ của chất đó, nghĩa là cân bằng sẽ chuyển dịch tương ứng theo chiều làm giảm hoặc tăng nồng độ của chất đó.
| Chất xúc tác không làm thay đổi nồng độ các chất trong hệ cân bằng và cũng không làm thay đổi hằng số cân bằng nên không làm chuyển dịch cân bằng. Chất xúc tác có tác dụng làm tăng tốc độ phản ứng thuận và phản ứng nghịch nên làm cho hệ nhanh chóng đạt trạng thái cân bằng. |
Bài tập minh họa
Bài 1. Một phản ứng thuận nghịch đạt đến trạng thái cân bằng khi
A. Phản ứng thuận đã kết thúc
B. Phản ứng nghịch đã kết thúc
C. Tốc độ của phản ứng thuận và nghịch bằng nhau.
D. Nồng độ của các chất tham gia phản ứng và của các chất sản phẩm phản ứng bằng nhau
Hướng dẫn giải
Một phản ứng thuận nghịch đạt đến trạng thái cân bằng khi tốc độ của phản ứng thuận và nghịch bằng nhau.
⇒ Chọn C
Bài 2. Chọn khẳng định không đúng
A. Các yếu tố ảnh hưởng đến cân bằng hóa học là: Nhiệt độ, nồng độ, áp suất, chất xúc tác
B. Cân bằng hóa học là cân bằng động
C. Khi thay đổi trạng thái cân bằng của phản ứng thuận nghịch, cân bằng sẽ chuyển dịch về phía chống lại sự thay đổi đó
D. Các yếu tố ảnh hưởng đến tốc độ phản ứng là: nồng độ, nhiệt độ, áp suất, chất xúc tác, diện tích bề mặt tiếp xúc
Hướng dẫn giải
A. Sai vì các yếu tố ảnh hưởng đến cân bằng hóa học là: Nhiệt độ, nồng độ, áp suất, còn chất xúc tác không ảnh hưởng đến cân bằng hoá học.
⇒ Chọn A
Luyện tập Bài 1 Hóa 11 Chân Trời Sáng Tạo
Học xong bài học này, em có thể:
– Trình bày được khái niệm phản ứng thuận nghịch và trạng thái cân bằng của phản ứng thuận nghịch.
– Viết được biểu thức hằng số cân bằng (K) của phản ứng thuận nghịch. Thực hiện được thí nghiệm nghiên cứu ảnh hưởng của nhiệt độ tới chuyển dịch cân bằng.
– Vận dụng được nguyên lí chuyển dịch cân bằng Le Chatelier (Lơ Sa-tơ- li-ê) để giải thích ảnh hưởng của nhiệt độ, nồng độ, áp suất đến cân bằng hóa học.
3.1. Trắc nghiệm Bài 1 Hóa 11 Chân Trời Sáng Tạo
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 11 CTST Bài 1 cực hay có đáp án và lời giải chi tiết.
-
- A. Phản ứng thuận đã kết thúc.
- B. Phản ứng nghịch đã kết thúc.
- C. Tốc độ của phản ứng thuận và nghịch bằng nhau.
- D. Nồng độ của các chất tham gia phản ứng và của các chất sản phẩm phản ứng bằng nhau.
-
- A. Nồng độ
- B. Nhiệt độ
- C. Áp suất
- D. Chất xúc tác
-
Câu 3:
Trong các phát biểu dưới đây, phát biểu đúng khi một hệ hóa học đang ở trạng thái cân bằng là
- A. Phản ứng thuận đã dừng
- B. Phản ứng nghịch đã dừng
- C. Nồng độ các chất tham gia và sản phẩm bằng nhau
- D. Nồng độ của các chất trong hệ không thay đổi
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 1 Hóa 11 Chân Trời Sáng Tạo
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 11 CTST Bài 1 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Mở đầu trang 5 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 1 trang 5 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hoạt động trang 5 SGK Hoá học 11 Chân trời sáng tạo – CTST
Thảo luận 2 trang 6 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hoạt động trang 6 SGK Hoá học 11 Chân trời sáng tạo – CTST
Thảo luận 3 trang 6 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 4 trang 6 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 5 trang 7 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 6 trang 7 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hoạt động trang 7 SGK Hoá học 11 Chân trời sáng tạo – CTST
Thảo luận 7 trang 7 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 8 trang 8 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 9 trang 8 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 10 trang 9 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 11 trang 9 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hoạt động 1 trang 9 SGK Hoá học 11 Chân trời sáng tạo – CTST
Thảo luận 12 trang 9 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hoạt động 2 trang 9 SGK Hoá học 11 Chân trời sáng tạo – CTST
Thảo luận 13 trang 10 SGK Hóa học 11 Chân trời sáng tạo – CTST
Vận dụng trang 10 SGK Hoá học 11 Chân trời sáng tạo – CTST
Giải Bài 1 trang 11 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 2 trang 11 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 3 trang 11 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 4 trang 11 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 5 trang 11 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hỏi đáp Bài 1 Hóa 11 Chân Trời Sáng Tạo
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!








