Gas dùng làm nhiên liệu đun nấu trong gia đình có thành phần chủ yếu là propane và butane. Đây là các alkane ở thể khí trong điều kiện thường nhưng được hoá lỏng dưới áp suất cao. Alkane là gì? Chúng có vai trò như thế nào trong đời sống, sản xuất?
Chúng ta hãy cùng tìm hiểu thông qua bài giảng và bài tập Bài 12: Alkane môn Hoá học 11 Chân trời sáng tạo, nội dung bài học đã được HOC247 tóm tắt ngắn gọn, chi tiết và đầy đủ các kiến thức quan trọng.
Hi vọng bài giảng sẽ giúp các em đạt được nhiều kiến thức bổ ích.
Tóm tắt lý thuyết
1.1. Khái niệm về alkane
a. Nguồn alkane trong tự nhiên
– Bề mặt những vũng đầm lầy thường xuất hiện các bong bóng khí, đó là alkane đơn giản nhất, có tên gọi methane
– Dầu mỏ trong tự nhiên cũng chứa thành phần chính là các alkane.
b. Công thức chung của alkane
.png)
– Các hydrocarbon trên đều có cấu tạo hoá học tương tự, phân tử chỉ chứa các liên kết đơn.
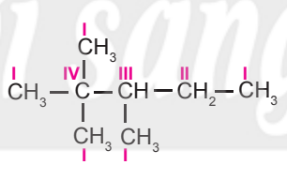
– Alkane không phân nhánh có mạch carbon chỉ chứa nguyên tử carbon bậc I và bậc II. Alkane phân nhánh có chứa nguyên tử carbon bậc III, bậc IV.
– Methane, ethane, propane, ... là những chất đầu tiên của dãy đồng đẳng alkane.
– Alkane là những hydrocarbon mạch hở chỉ chứa liên kết đơn trong phân tử và có công thức chung CnH2n+2 (n≥1).
|
Bậc của một nguyên tử carbon trong phân tử alkane được xác định bằng số nguyên tử carbon liên kết trực tiếp với nguyên tử carbon đó. Bậc của các nguyên tử carbon được kí hiệu bằng số La Mã.
|
1.2. Danh pháp alkane
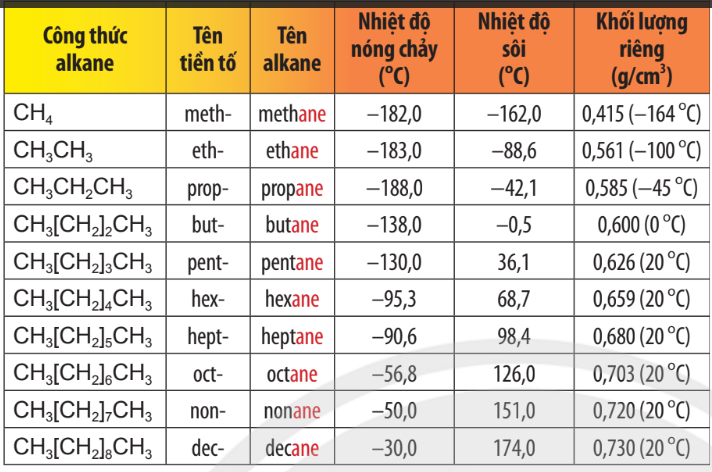
Tên theo danh pháp thay thế của 10 alkane không phân nhánh đầu tiên trong dãy đồng đẳng được trình bày trong Bảng 12.1.
Bảng 12.1. Tên gọi 10 alkane không phân nhánh đầu tiên và một số tính chất vật lí của chúng
– Tên theo danh pháp thay thế của các alkane phân nhánh được gọi như sau:
+ Chọn mạch chính là mạch carbon dài nhất. Đánh số Ả Rập các nguyên tử carbon trên mạch chính sao cho tổng số chỉ vị trí các nhánh là nhỏ nhất.
+ Tên nhánh là tên gốc alkyl. Gốc alkyl là phần còn lại sau khi loại đi 1 nguyên tử H của alkane.
+ Tên gốc alkyl được gọi theo tên alkane nhưng bỏ ane, thêm yl (thay đuôi ane trong alkane bång yl).
+ Giữa phần số với phần chữ dùng dấu “-” giữa phần số với phần số dùng dấu“, ”
+ Khi đọc tên nhánh phải kèm theo số chỉ vị trí của nhánh. Nếu có nhiều nhánh, ưu tiên tên các nhánh theo thứ tự chữ cái đầu tiên của tên nhánh.
+ Khi có 2, 3 hoặc 4, ... nhánh giống nhau, dùng các tiếp đầu ngữ di, tri hoặc tetra, ...
Ví dụ:
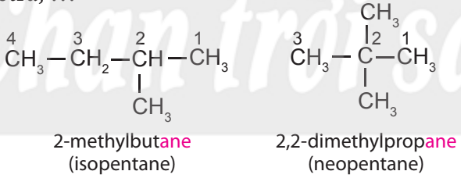
– Tên theo danh pháp thay thế của alkane không phân nhánh

Tiền tố ứng với số nguyên tử carbon của alkane
– Tên theo danh pháp thay thế của alkane phân nhánh

1.3. Tính chất vật lí
- Ở điều kiện thường, alkane từ C1 đến C4 và neopentane ở trạng thái khí, từ C5 đến C17 (trừ neopentane) ở trạng thái lỏng, không màu, alkane từ C18 trở lên là chất rắn màu trắng (còn gọi là sáp paraffin).
- Các alkane mạch nhánh thường có nhiệt độ sôi thấp hơn so với đồng phân alkane mạch không phân nhánh.
- Alkane không tan hoặc tan rất ít trong nước và nhẹ hơn nước, tan tốt hơn trong các dung môi hữu cơ.
1.4. Tính chất hoá học
Do phân tử chỉ chứa liên kết \(\sigma\) bền, không phân cực nên alkane tương đối trơ về mặt hoá học.
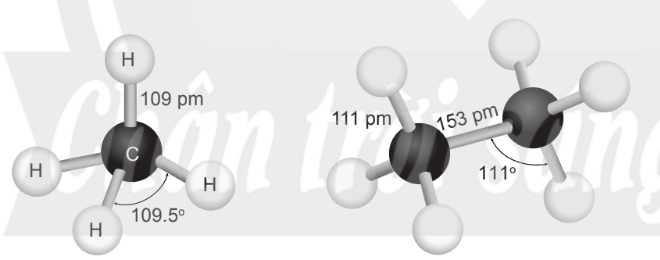
Hình 12.1. Mô hình phân tử methane và ethane
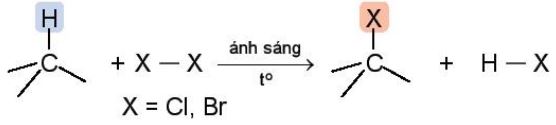
a. Phản ứng thế halogen
| Phản ứng thế halogen là phản ứng đặc trưng của alkane. Nguyên tử hydrogen liên kết với nguyên tử carbon bậc cao dễ bị thế bởi nguyên tử halogen hơn so với nguyên tử hydrogen liên kết với nguyên tử carbon bậc thấp hơn. |
Ví dụ: CH4 + Cl2 \(\xrightarrow{ánh\,sáng}\) CH3Cl + HCl
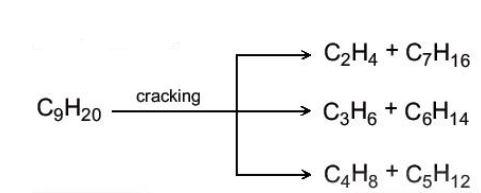
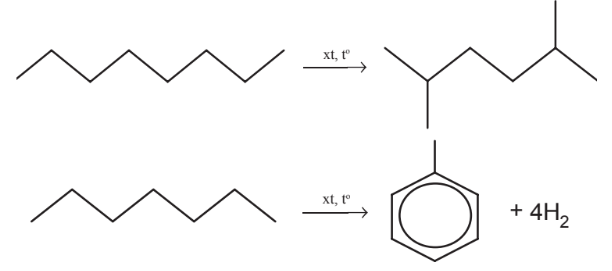
b. Phản ứng cracking
| Cracking alkane là quá trình “bẻ gãy” các phân tử alkane mạch dài thành các phân tử hydrocarbon mạch ngắn hơn. |
Ví dụ:
c. Phản ứng refoming
| Reforming là quá trình biến đổi cấu trúc phân tử hydrocarbon từ mạch không nhánh thành mạch nhánh, từ mạch hở thành mạch vòng, từ không thơm thành thơm. Quá trình reforming thường diễn ra ở nhiệt độ cao và có xúc tác. |
Ví dụ:
d. Phản ứng oxi hoá
Oxi hoá hoàn toàn: Các alkane thường dễ cháy và toả nhiều nhiệt nên nhiều alkane được dùng làm nhiên liệu.
Ví dụ:
CH4(g) + 2O2(g) \(\xrightarrow{{{t}^{o}}}\) CO2(g) + 2H2O(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) = - 890 kJ/mol
C3H8(g) + 5O2(g) \(\xrightarrow{{{t}^{o}}}\) 3O2(g) + 4H2O(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) = - 2216 kJ/mol
Oxi hoá không hoàn toàn: Trong trường hợp thiếu oxygen, phản ứng cháy xảy ra không hoàn toàn, tạo CO và có thể có C, gây ô nhiễm môi trường.
Ví dụ: 2C5H12 + 11O2 \(\xrightarrow{{{t}^{o}}}\) 10CO + 12H2O
1.5. Ứng dụng của alkane và điều chế alkane trong công nghiệp
a. Ứng dụng
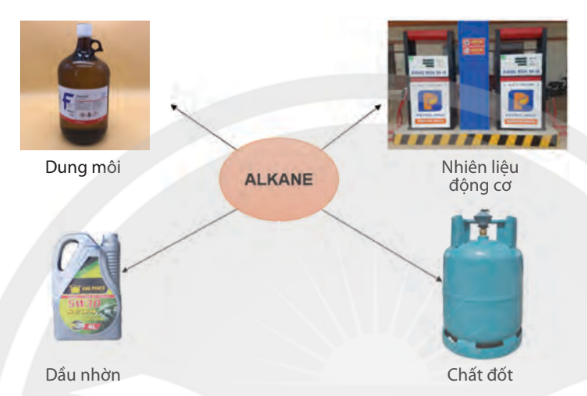
Hình 12.2. Một số ứng dụng của alkane trong đời sống
b. Điều chế
– Từ dầu mỏ, bằng phương pháp chưng cất phân đoạn, thu được các alkane ở các phân đoạn khác nhau như xăng, dầu hoả, dầu diesel, dầu nhờn, ... và nhựa đường.
– Trong công nghiệp, alkane được khai thác, chế biến từ khí thiên nhiên, khí đồng hành, dầu mỏ.
c. Một số nguyên nhân gây ô nhiễm không khí do các phương tiện giao thông và cách giảm thiểu, hạn chế
– Khí thải do các phương tiện giao thông hoạt động thải ra trong quá trình đốt cháy nhiên liệu là hỗn hợp của các khí và các hạt khác nhau.
– Khói thải và các hạt bụi mịn thải vào khí quyển là tác nhân gây ảnh hưởng nghiêm trọng đến sức khoẻ người dân.

Hình 12.3. Nguồn ô nhiễm do các phương tiện giao thông
Bài tập minh họa
Bài 1. Hãy viết các đồng phân cấu tạo ứng với công thức phân tử C5H12.
Hướng dẫn giải
C5H12 có 3 đồng phân cấu tạo là:
CH3-CH2-CH2-CH2-CH3; CH3-CH(CH3)-CH2-CH3; CH3-C(CH3)2-CH3
Bài 2. Hãy gọi tên thay thế của hợp chất (CH3)2CHCH2CH2CH3?
Hướng dẫn giải
\(\begin{array}{*{35}{l}} \overset{1}{\mathop{C}}\,{{H}_{3}}-\underset{\,\left| {} \right.}{\overset{2}{\mathop{C}}}\,H-\overset{3}{\mathop{C}}\,{{H}_{2}}-\overset{4}{\mathop{C}}\,{{H}_{2}}-\overset{5}{\mathop{C}}\,{{H}_{3}} \\ \text{ }\!\!~\!\!\text{ }\!\!~\!\!\text{ }\!\!~\!\!\text{ }\!\!~\!\!\text{ }\!\!~\!\!\text{ }\!\!~\!\!\text{ }\!\!~\!\!\text{ }\!\!~\!\!\text{ }\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,C{{H}_{3}} \\ \end{array}\)
2-methylpentane
Luyện tập Bài 12 Hóa 11 Chân Trời Sáng Tạo
Học xong bài học này, em có thể:
– Nêu được khái niệm, công thức chung và nguồn alkane trong tự nhiên.
– Trình bày được quy tắc gọi tên theo danh pháp thay thế; áp dụng gọi được tên cho một số alkane (C1 - C10) mạch không phân nhánh và một số alkane mạch nhánh chứa không quá 5 nguyên tử C.
– Giải thích được đặc điểm về tính chất vật lí và tính chất hoá học của alkane.
– Trình bày được các ứng dụng trong thực tiễn và cách điều chế alkane trong công nghiệp.
3.1. Trắc nghiệm Bài 12 Hóa 11 Chân Trời Sáng Tạo
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 11 CTST Bài 12 cực hay có đáp án và lời giải chi tiết.
-
- A. CnHn+2
- B. CnH2n+2
- C. CnH2n
- D. CnH2n-2
-
- A. C10H22
- B. C8H16
- C. C6H6
- D. CnH2n-2
-
- A. Cộng với halogen
- B. Thế với halogen
- C. Cracking
- D. Đề hydrogen hoá
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 12 Hóa 11 Chân Trời Sáng Tạo
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 11 CTST Bài 12 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Mở đầu trang 66 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 1 trang 67 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 2 trang 67 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hoạt động trang 67 SGK Hoá học 11 Chân trời sáng tạo – CTST
Thảo luận 3 trang 68 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hoạt động trang 68 SGK Hoá học 11 Chân trời sáng tạo – CTST
Thảo luận 4 trang 69 SGK Hóa học 11 Chân trời sáng tạo – CTST
Vận dụng trang 69 SGK Hoá học 11 Chân trời sáng tạo – CTST
Thảo luận 5 trang 69 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 6 trang 70 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 7 trang 70 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hoạt động trang 70 SGK Hoá học 11 Chân trời sáng tạo – CTST
Thảo luận 8 trang 70 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hoạt động trang 71 SGK Hoá học 11 Chân trời sáng tạo – CTST
Thảo luận 9 trang 71 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 10 trang 71 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 11 trang 72 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hoạt động trang 73 SGK Hoá học 11 Chân trời sáng tạo – CTST
Vận dụng trang 73 SGK Hoá học 11 Chân trời sáng tạo – CTST
Giải Bài 1 trang 73 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 2 trang 73 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 3 trang 73 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hỏi đáp Bài 12 Hóa 11 Chân Trời Sáng Tạo
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!