Hướng dẫn Giải bài tập Hóa học 10 Cánh Diều Bài 5 Bài 5: Lớp, phân lớp và cấu hình electron môn Hóa lớp 10 Cánh Diều giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức.
-
Giải câu hỏi 1 trang 26 SGK Hóa học 10 Cánh Diều - CD
Vì sao số AO trong một lớp luôn bằng một nửa số electron tối đa thuộc lớp đó?
-
Luyện tập trang 27 SGK Hóa học 10 Cánh Diều - CD
Lớp ngoài cùng của nitrogen (Z = 7) có bao nhiêu electron, bao nhiêu AO?
-
Giải câu hỏi 2 trang 27 SGK Hóa học 10 Cánh Diều - CD
Các ô (1), (2), (3), (4) trong hình dưới đây liên hệ với nội dung nào về cấu tạo lớp vỏ nguyên tử?
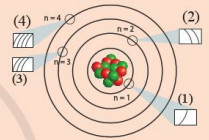
-
Giải câu hỏi 3 trang 27 SGK Hóa học 10 Cánh Diều - CD
Lớp electron thứ tư (n = 4) có bao nhiêu phân lớp và kí hiệu các phân lớp này là gì?
-
Giải câu hỏi 4 trang 27 SGK Hóa học 10 Cánh Diều - CD
Tính số electron tối đa (bão hòa) trên mỗi phân lớp ns, np, nd, nf.
-
Luyện tập trang 28 SGK Hóa học 10 Cánh Diều - CD
Viết cấu hình electron của các nguyên tố có số hiệu nguyên tử từ 1 đến 20
-
Luyện tập trang 29 SGK Hóa học 10 Cánh Diều - CD
Biểu diễn cấu hình theo ô orbital (chỉ với lớp ngoài cùng) các nguyên tử có Z từ 1 đến 20. Xác định số electron độc thân của mỗi nguyên tử.
-
Luyện tập trang 30 SGK Hóa học 10 Cánh Diều - CD
Dự đoán tính chất hóa học cơ bản (tính kim loại, tính phi kim) của các nguyên tố có Z từ 1 đến 20.
-
Giải bài 1 trang 30 SGK Hóa học 10 Cánh Diều - CD
Những phát biểu nào sau đây là đúng?
(a) Orbital 1s có dạng hình cầu, orbital 2s có dạng hình số tám nổi.
(b) Trong một nguyên tử, năng lượng của electron thuộc AO 1s thấp hơn năng lượng của electron thuộc AO 2s.
(c) Trong một nguyên tử, năng lượng của electron thuộc AO 2s thấp hơn năng lượng của electron thuộc AO 2p.
(d) Trong một nguyên tử, năng lượng của electron thuộc AO 2s gần năng lượng của electron thuộc AO 2p.
-
Giải bài 2 trang 30 SGK Hóa học 10 Cánh Diều - CD
Nguyên tử nguyên tố X có hai lớp electron, trong đó có một electron độc thân. Vậy X có thể là những nguyên tố nào?
-
Giải bài 3 trang 30 SGK Hóa học 10 Cánh Diều - CD
Cấu hình electron của ion được thiết lập bằng cách thêm hoặc bớt electron, bắt đầu từ phân lớp ngoài cùng của cấu hình electron nguyên tử tương ứng.
a) Viết cấu hình electron của Na+ và Cl-.
b) Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp nào của Cl? AO đó là AO trống, chứa 1 hay 2 electron?
-
Giải bài 5.1 trang 12 SBT Hóa học 10 Cánh Diều - CD
Phát biểu nào sau đây là đúng?
A. Electron trong cùng một lớp có năng lượng bằng nhau.
B. Electron trong cùng một phân lớp có năng lượng bằng nhau.
C. Electron ở các phân lớp 1s; 2s; 3s có năng lượng bằng nhau.
D. Electron ở lớp bên ngoài có năng lượng thấp hơn electron ở lớp bên trong.
-
Giải bài 5.2 trang 13 SBT Hóa học 10 Cánh Diều - CD
Phát biểu nào sau đây không đúng?
A. Electron càng ở xa hạt nhân thì có năng lượng càng thấp.
B. Số lượng electron tối đa trong một phân lớp luôn là một số chẵn.
C. Phân lớp p có nhiều orbital hơn phân lớp s.
D. Số electron tối đa trên phân lớp p gấp ba lần số electron tối đa trên phân lớp s.
-
Giải bài 5.3 trang 13 SBT Hóa học 10 Cánh Diều - CD
Mỗi phát biểu sau đây là đúng hay sai?
(1) Số lượng orbital trong các phân lớp 1s, 2s, 3s là bằng nhau.
(2) Số lượng orbital trong các phân lớp 3s, 3p, 3d là bằng nhau.
(3) Các electron trên các phân lớp 1s, 2s, 3s có năng lượng bằng nhau.
(4) Các electron trên các phân lớp 3s, 3p, 3d có năng lượng bằng nhau.
(5) Số lượng electron tối đa trong một lớp là 2n2.
(6) Số lượng các orbital trong một phân lớp (s, p, d, f) luôn là một số lẻ.
-
Giải bài 5.4 trang 13 SBT Hóa học 10 Cánh Diều - CD
Điền từ/ cụm từ hoặc số thích hợp vào chỗ trống trong mỗi phát biểu sau:
a) Các electron trong lớp vỏ nguyên tử được phân bố vào các ...(1)... và ...(2)... dựa theo năng lượng của chúng. Các electron thuộc cùng một lớp có năng lượng ...(3)..., các electron thuộc cùng một phân lớp có năng lượng ...(4).... Các electron ở ...(5)... có vai trò quyết định đến tính chất hoá học đặc trưng của nguyên tố.
b) Magnesium được sử dụng nhiều trong công nghiệp để chế tạo các bộ phận của máy bay, ô tô. Nguyên tử magnesium có 12 electron, được phân bố vào ...(1)... lớp. Lớp ngoài cùng của magnesium có ...(2)... electron.
-
Giải bài 5.5 trang 13 SBT Hóa học 10 Cánh Diều - CD
Số phân lớp bão hòa trong các phân lớp: 1s2; 2s2; 2p3; 3d10; 3p4 là
A. 1. B. 2. C. 3. D. 5.
-
Giải bài 5.6 trang 13 SBT Hóa học 10 Cánh Diều - CD
Ghép mỗi biểu diễn ô orbital của phân lớp p ở cột A với mô tả thích hợp ở cột B.

-
Giải bài 5.7 trang 14 SBT Hóa học 10 Cánh Diều - CD
Nguyên tử O có 8 electron. Biểu diễn sự sắp xếp electron trong nguyên tử O theo orbital nào sau đây là đúng?
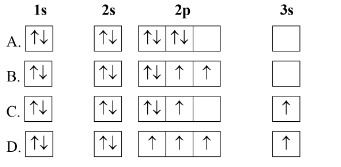
-
Giải bài 5.8 trang 14 SBT Hóa học 10 Cánh Diều - CD
Các nguyên tử Ne, Na và F có Z lần lượt là 10, 11 và 9. Cấu hình electron của Ne, Na+ và F- tương ứng là:
A. 1s22s22p6; 1s22s22p63s1 và 1s22s22p5.
B. đều có cấu hình 1s22s22p6.
C. 1s22s22p6; 1s22s22p5 và 1s22s22p4.
D. 1s22s22p6; 1s22s22p5; 1s22s22p3.
-
Giải bài 5.9 trang 14 SBT Hóa học 10 Cánh Diều - CD
Biết rằng điện tích hạt nhân của C, N, O và F lần lượt là 6, 7, 8, 9. Ghép mỗi cấu hình electron ở cột A với nguyên tử/ ion thích hợp ở cột B.

-
Giải bài 5.10 trang 14 SBT Hóa học 10 Cánh Diều - CD
Trong các nguyên tử N (Z = 7), O (Z = 8), F (Z = 9) và Ne (Z = 10), nguyên tử có nhiều electron độc thân nhất là
A. N. B. O. C. F. D. Ne.
-
Giải bài 5.11 trang 14 SBT Hóa học 10 Cánh Diều - CD
Nối mỗi cấu hình electron của nguyên tử ở cột A với các loại nguyên tố hóa học thích hợp ở cột B.

-
Giải bài 5.12 trang 15 SBT Hóa học 10 Cánh Diều - CD
Cấu hình electron của một nguyên tử được biểu diễn dưới dạng các ô orbital như sau:
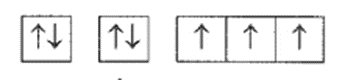
Số electron hóa trị và tính chất đặc trưng của nguyên tố hóa học này là
A. 3, tính kim loại. B. 5, tính phi kim.
C. 7, tính phi kim. D. 4, tính kim loại.
-
Giải bài 5.13 trang 15 SBT Hóa học 10 Cánh Diều - CD
Cho các cấu hình electron của một số nguyên tử nguyên tố như sau:
(1) 1s22s22p6
(2) 1s22s22p63s2
(3) 1s22s22p63s23p63d64s2
(4) 1s22s22p63s23p63d14s2
(5) 1s22s22p63s23p4
(6) 1s22s22p63s23p5
Số lượng các nguyên tố kim loại trong số các nguyên tố ở trên là
A. 1. B. 2. C. 3. D. 4.
-
Giải bài 5.14 trang 15 SBT Hóa học 10 Cánh Diều - CD
Từ các nguyên tử có thể tạo ra các ion bằng cách thêm hoặc bớt electron từ nguyên tử đó.
a) Oxygen là nguyên tố chiếm tỉ lệ phần trăm khối lượng cao nhất trong cơ thể con người (khoảng 65%). Hãy viết cấu hình electron của O và O2- (Z = 8). Cho biết để hình thành ion O2-, nguyên tử O sẽ nhận thêm electron vào orbital nào. Xác định số electron độc thân trong nguyên tử và ion này.
b) Nhôm (aluminium) được sử dụng phổ biến trong đời sống (chế tạo dụng cụ nhà bếp, cửa, …) cũng như công nghiệp (chế tạo một số bộ phận của máy bay). Hãy biểu diễn cấu hình electron của Al và ion Al3+ (Z = 13) dưới dạng ô orbital. Cho biết để tạo thành ion Al3+, nguyên tử Al sẽ mất đi electron từ orbital nào. Xác định số electron độc thân trong các nguyên tử và ion này.
-
Giải bài 5.15 trang 16 SBT Hóa học 10 Cánh Diều - CD
Hãy cho biết những nguyên tử và ion (cation mang điện tích 1+, 2+ hoặc anion mang điện tích 1-, 2-) nào có cấu hình electron là 1s22s22p6.
-
Giải bài 5.16 trang 16 SBT Hóa học 10 Cánh Diều - CD
Tại một khu vực của Úc, gia súc không phát triển mạnh mặc dù có thức ăn thô xanh thích hợp. Một cuộc điều tra cho thấy nguyên nhân là do không có đủ cobalt trong đất. Cobalt tạo thành cation ở hai dạng là Co2+ và Co3+ (Z = 27). Viết cấu hình electron của hai cation này và sơ đồ phân bố các electron vào các ô orbital. Cho biết số electron độc thân trong mỗi ion.
-
Giải bài 5.17 trang 16 SBT Hóa học 10 Cánh Diều - CD
Bromine (Z = 35) dễ phản ứng, trong khi krypton (Z = 36) tương đối trơ về mặt hóa học. Giải thích sự khác biệt này dựa trên cấu hình electron của chúng.
-
Giải bài 5.18 trang 16 SBT Hóa học 10 Cánh Diều - CD
Cũng giống như nam châm, mỗi nguyên tử/ ion cũng có thể có từ tính (bị nam châm hút). Nếu nguyên tử/ ion có electron độc thân thì nó có từ tính và được gọi là chất thuận từ. Ngược lại, nguyên tử/ ion nếu không có electron độc thân thì được gọi là chất nghịch từ. Hãy giải thích vì sao nguyên tử Cu (Z = 29) thuận từ nhưng ion Cu+ lại nghịch từ.






