Hydrogen Halide v├Ā Hydrohalic Acid l├Ā g├¼? C├│ t├Łnh chß║źt vß║Łt l├Ł v├Ā h├│a hß╗Źc ra sao ? ─Éß╗ā biß║┐t chi tiß║┐t hŲĪn, HOC247 xin chia sß║╗ vß╗øi c├Īc bß║Īn B├Āi 18: Hydrogen Halide v├Ā Hydrohalic Acid m├┤n H├│a hß╗Źc 10 SGK C├Īnh Diß╗üu. Vß╗øi l├Į thuyß║┐t v├Ā c├Īc b├Āi tß║Łp c├│ lß╗Øi giß║Żi chi tiß║┐t, hi vß╗Źng rß║▒ng ─æ├óy sß║Į l├Ā t├Āi liß╗ću gi├║p c├Īc bß║Īn hß╗Źc tß║Łp tß╗æt hŲĪn!
T├│m tß║»t l├Į thuyß║┐t
1.1. Hydrogen Halide v├Ā Hydrohalic Acid
a. Hydrogen Halide
- Hß╗Żp chß║źt gß╗ōm nguy├¬n tß╗æ halogen v├Ā nguy├¬n tß╗æ hydrogen, c├│ dß║Īng HX, ─æŲ░ß╗Żc gß╗Źi chung l├Ā hydrogen halide. ─É├óy l├Ā c├Īc hß╗Żp chß║źt cß╗Öng ho├Ī trß╗ŗ ph├ón cß╗▒c do sß╗▒ ch├¬nh lß╗ćch ─æß╗Ö ß║®m ─æiß╗ćn giß╗»a nguy├¬n tß╗Ł hydrogen vß╗øi c├Īc nguy├¬n tß╗Ł halogen.
- Sß╗▒ ph├ón cß╗▒c ─æŲ░ß╗Żc biß╗āu diß╗ģn nhŲ░ sau: \({H^{\delta + }}:{X^{\delta - }}\)
- Xu hŲ░ß╗øng ph├ón cß╗▒c giß║Żm dß║¦n tß╗½ HF ─æß║┐n HI.
- Nhiß╗ćt ─æß╗Ö s├┤i cß╗¦a c├Īc hydrogenhalide ─æŲ░ß╗Żc ghi ß╗¤ Bß║Żng 18.1.
Bß║Żng 18.1. Nhiß╗ćt ─æß╗Ö s├┤i cß╗¦a cß╗¦a c├Īc hydrogen halide
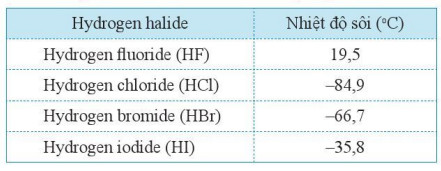
- Gi├Ī trß╗ŗ nhiß╗ćt ─æß╗Ö s├┤i cß╗¦a c├Īc hydrogen halide cho thß║źy ß╗¤ ─æiß╗üu kiß╗ćn thŲ░ß╗Øng ch├║ng l├Ā c├Īc chß║źt kh├Ł.
- Bß║Żng 18.1 chß╗ē ra rß║▒ng nhiß╗ćt ─æß╗Ö s├┤i t─āng tß╗½ hydrogen chloride ─æß║┐n hydrogen iodide. Xu hŲ░ß╗øng t─āng nhiß╗ćt ─æß╗Ö s├┤i n├Āy ─æŲ░ß╗Żc giß║Żi th├Łch bß╗¤i hai nguy├¬n nh├ón.
+ Thß╗® nhß║źt, sß╗▒ t─āng khß╗æi lŲ░ß╗Żng ph├ón tß╗Ł tß╗½ HCl ─æß║┐n HI l├Ām t─āng n─āng lŲ░ß╗Żng cß║¦n thiß║┐t cho qu├Ī tr├¼nh s├┤i cß╗¦a chß║źt.
+ Thß╗® hai, sß╗▒ t─āng k├Łch thŲ░ß╗øc v├Ā sß╗æ lŲ░ß╗Żng electron trong c├Īc ph├ón tß╗Ł tß╗½ HCl ─æß║┐n HI l├Ām t─āng cŲ░ß╗Øng th├¬m khß║Ż n─āng xuß║źt hiß╗ćn c├Īc lŲ░ß╗Īng cß╗▒c tß║Īm thß╗Øi trong ph├ón tß╗Ł. Khi ─æ├│ l├Ām t─āng tŲ░ŲĪng t├Īc van der Waals giß╗»a c├Īc ph├ón tß╗Ł.
- Ri├¬ng hydrogen fluoride c├│ nhiß╗ćt ─æß╗Ö s├┤i cao bß║źt thŲ░ß╗Øng so vß╗øi c├Īc chß║źt c├▓n lß║Īi trong d├Ży. ─Éiß╗üu n├Āy ─æŲ░ß╗Żc giß║Żi th├Łch chß╗¦ yß║┐u l├Ā do giß╗»a c├Īc ph├ón tß╗Ł hydrogen fluoride c├▓n tß║Īo li├¬n kß║┐t hydrogen vß╗øi nhau:
...F-H... F-H... ŌåÆ [HF]n vß╗øi gi├Ī trß╗ŗ trung b├¼nh cß╗¦a n tß╗½ 5 ─æß║┐n 6.
- V├¼ tß╗ōn tß║Īi dŲ░ß╗øi dß║Īng [HF]n n├¬n hydrogen fluoride kh├│ bay hŲĪi hŲĪn c├Īc hydrogen halide c├▓n lß║Īi.
b. Hydrohalic acid
- C├Īc hydrogenhalide dß╗ģ tan trong nŲ░ß╗øc v├Ā ph├ón tß╗Ł ph├ón cß╗▒c. Chß║│ng hß║Īn, ß╗¤ 20┬░C, 1 thß╗ā t├Łch nŲ░ß╗øc c├│ thß╗ā ho├Ān tan ─æß╗ān 500 thß╗ā t├Łch kh├Ł hydrogen chloride. Trong dung dß╗ŗch, hydrogen halide ─æß╗üu ph├ón li ra ion H+ n├¬n ─æŲ░ß╗Żc gß╗Źi l├Ā hydrohalic acid (hay c├Īc acid HX).
- V├Ł dß╗ź, sß╗▒ ph├ón li cß╗¦a hydrogen chloride trong nŲ░ß╗øc nhŲ░ sau: HCl (aq) ŌåÆ H+ (aq) + Cl- (aq)
- T├Łnh acid cß╗¦a c├Īc dung dß╗ŗch HX t─āng theo d├Ży tß╗½ HF ─æß║┐n HI. Trong ─æ├│, hydrofluoric acid l├Ā acid yß║┐u do chß╗ē ph├ón li mß╗Öt phß║¦n trong nŲ░ß╗øc. C├▓n hydrochloric acid, hydrobromic acid v├Ā hydroiodic acid ─æŲ░ß╗Żc xß║┐p v├Āo loß║Īi acid mß║Īnh do ph├ón li ho├Ān to├Ān trong nŲ░ß╗øc. Nguy├¬n nh├ón chß╗¦ yß║┐u l├Ām t─āng ─æß╗Ö mß║Īnh cß╗¦a c├Īc acid theo d├Ży tr├¬n l├Ā do sß╗▒ giß║Żm ─æß╗Ö bß╗ün li├¬n kß║┐t theo thß╗® tß╗▒ HF, HCl, HBr, HI.
|
- Trong d├Ży hydrogen halide, nhiß╗ćt ─æß╗Ö s├┤i t─āng dß║¦n tß╗½ hydrogen chloride dß║┐n hydrogen iodide. Ri├¬ng hydrogen fluoride c├│ nhiß╗ćt ─æß╗Ö s├┤i cao bß║źt thŲ░ß╗Øng do c├Īc ph├ón tß╗Ł HF tß║Īo li├¬n kß║┐t hydrogen vß╗øi nhau. - Trong d├óy c├Īc hydrohalic acid, t├Łnh acid t─āng dß║¦n tß╗½ hydrofluoric acid (HF) ─æß║┐n hydroiodic acid (HI). |
|---|
1.2. T├Łnh khß╗Ł cß╗¦a mß╗Öt sß╗æ ion Halide X-
- C├Īc hß╗Żp chß║źt chß╗®a ion Cl-, Br-,I- phß║Żn ß╗®ng ─æŲ░ß╗Żc vß╗øi sulfuric acid ─æß║Ęc. Tuy nhi├¬n, c├Īc sß║Żn phß║®m l├Ā kh├┤ng giß╗æng nhau.
- Bß║Żng 18,2 m├┤ tß║Ż phß║Żn ß╗®ng cß╗¦a sodium chloride (chß╗®a Cl-), sodium bromide (chß╗®a Br-) v├Ā sodium iodide (chß╗®a I-), ─æß╗üu thß╗ā rß║»n vß╗øi sulfuric acid ─æß║Ęc.
Bß║Żng 18.2. Phß║Żn ß╗®ng cß╗¦a mß╗Öt sß╗æ sodium halide vß╗øi sulfuric acid ─æß║Ęc, ─æun n├│ng

- Tß╗½ c├Īc phß║Żn ß╗®ng tr├¬n cho thß║źy khi phß║Żn ß╗®ng vß╗øi sulfuric acid ─æß║Ęc th├¼:
+ Ion Cl- kh├┤ng thß╗ā hiß╗ćn t├Łnh khß╗Ł.
+ Ion Br- thß╗ā hiß╗ćn t├Łnh khß╗Ł v├Ā khß╗Ł sulfur trong H2SO4 tß╗½ sß╗æ oxi ho├Ī +6 vß╗ü sß╗æ oxi ho├Ī +4 trong SO2.
+ Ion I- thß╗ā hiß╗ćn t├Łnh khß╗Ł v├Ā khß╗Ł sulfur trong H2SO4 tß╗½ sß╗æ oxi ho├Ī +6 vß╗ü sß╗æ oxi ho├Ī -2 trong H2S.
- V├¼ vß║Ły, khi phß║Żn ß╗®ng vß╗øi sulfuric acid ─æß║Ęc, Br- c├│ t├Łnh khß╗Ł yß╗āu hŲĪn I-.
- Thß╗▒c tß║┐, khi tiß║┐p x├║c vß╗øi c├Īc chß║źt oxi ho├Ī kh├Īc nhau th├¼ t├Łnh khß╗Ł cß╗¦a ion X- thŲ░ß╗Øng t─āng tß╗½ Cl- ─æß║┐n I-
1.3. ß╗©ng dß╗źng cß╗¦a mß╗Öt sß╗æ Hydrogen Halide
- Trong c├Īc hydrogen halide thi hydrogen fluoride v├Ā hydrogen chloride c├│ nhiß╗üu ß╗®ng dß╗źng phß╗Ģ biß║┐n hŲĪn.
a. ß╗©ng dß╗źng cß╗¦a hydrogen fluoride
- TrŲ░ß╗øc ─æ├óy, ß╗®ng dß╗źng phß╗Ģ biß║┐n cß╗¦a hydrogen fluoride l├Ā sß║Żn xuß║źt c├Īc hß╗Żp chß║źt chlorofluorocarbon hay c├▓n gß╗Źi l├Ā c├Īc hß╗Żp chß║źt CFC, ─æŲ░ß╗Żc sß╗Ł dß╗źng cho c├Īc hß╗ć thß╗æng l├Ām lß║Īnh. Tuy nhi├¬n, do t├Īc ─æß╗Öng ph├Ī huß╗Ę tß║¦ng ozone n├¬n ─æß║¦u thß║┐ kß╗ē XXI, c├Īc hß╗Żp chß║źt CFC ─æ├Ż bß╗ŗ cß║źm sß║Żn xuß║źt. Gß║¦n ─æ├óy, tß╗Ł hydrogen fluoride, ngŲ░ß╗Øi ta sß║Żn xuß║źt hydrochlorofluorocarbon (HCFC) thay thß║┐ CFC.
- Mß╗Öt lŲ░ß╗Żng ─æ├Īng kß╗ā hydrogen fluoride ─æŲ░ß╗Żc d├╣ng trong sß║Żn xuß║źt cryolite (th├Ānh phß║¦n ch├Łnh l├Ā Na AlF), ─æ├│ng vai tr├▓ ŌĆ£chß║źt chß║ŻyŌĆØ trong qu├Ī tr├¼nh sß║Żn xuß║źt nh├┤m aluminium) tß╗½ aluminium oxide Hydrogen fluoride c├▓n ─æŲ░ß╗Żc sß╗Ł dß╗źng trong c├Īc qu├Ī tr├¼nh chß║┐ biß║┐n dß║¦u mß╗Å, trong c├┤ng nghiß╗ćp hß║Īt nh├ón, trong sß║Żn xuß║źt c├Īc fluoride,..
- Dung dß╗ŗch nŲ░ß╗øc cß╗¦a hydrogen fluoride l├Ā hydrofluoric acid c├│ khß║Ż n─āng ho├Ā tan silicon dioxide n├¬n ─æŲ░ß╗Żc sß╗Ł dß╗źng ─æß╗ā khß║»c c├Īc chi tiß║┐t l├¬n thuß╗Ę tinh theo phß║Żn ß╗®ng
SiO2 (s) + 4HF(aq) ŌåÆ SiF4(g) + 2H2O(l)
b. ß╗©ng dß╗źng cß╗¦a hydrogen chloride
- Hiß╗ćn nay, mß╗Śi n─ām thß║┐ giß╗øi sß║Żn xuß║źt h├Āng chß╗źc triß╗ću tß║źn hydrochloric acid to hydrogen chloride.
- LŲ░ß╗Żng lß╗øn hydrogen chloride v├Ā hydrochloric acid ─æŲ░ß╗Żc sß╗Ł dß╗źng ─æß╗ā sß║Żn xuß║źt vinyl chloride cung cß║źp cho ng├Ānh nhß╗▒a, ammonium chloride ─æß╗ā cung cß║źp cho ng├Ānh sß║Żn xuß║źt ph├ón b├│n, c├Īc chloride kim loß║Īi ─æß╗ā cung cß║źp cho ng├Ānh ho├Ī chß║źt, c├Īc hß╗Żp chß║źt hß╗»u cŲĪ chß╗Ła chlorine ─æß╗ā phß╗źc vß╗ź sß║Żn xuß║źt dŲ░ß╗Żc phß║®m, thuß╗æc nhuß╗Öm.
- Dung dß╗ŗch nŲ░ß╗øc cß╗¦a hydrogen chloride l├Ā hydrochloric acid ─æŲ░ß╗Żc d├╣ng ─æß╗ā trung ho├Ā m├┤i trŲ░ß╗¤ng base, hoß║Ęc thuß╗Ę ph├ón c├Īc chß║źt trong c├Īc qu├Ī tr├¼nh sß║Żn xuß║źt, tß║®y rß╗Ła gß╗ē s├®t (th├Ānh phß║¦n ch├Łnh l├Ā c├Īc iron oxide) b├Īm tr├¬n bß╗ü mß║Ęt cß╗¦a c├Īc loß║Īi th├®p. DŲ░ß╗øi ─æ├óy mß╗Öt phß║Żn ß╗®ng minh hoß║Ī.
Fe2O3(s) + 6HCl(aq) ŌåÆ 2FeCl3(aq) + 3H2O (l)
1.4. Ph├ón biß╗ćt c├Īc ion Halide X-
- Khi nhß╗Å dung dß╗ŗch silver nitrate v├Āo dung dß╗ŗch acid HX hoß║Ęc muß╗æi halide, sß║Į quan s├Īt ─æŲ░ß╗Żc c├Īc hiß╗ćn tŲ░ß╗Żng kh├Īc nhau, tuß╗│ thuß╗Öc v├Āo ion halide X-.
- Trong đó:
+ Khi X- l├Ā F- th├¼ kh├┤ng thß║źy hiß╗ćn tŲ░ß╗Żng xß║Ży ra.
+ Khi X- l├Ā Cl- th├¼ xuß║źt hiß╗ćn kß║┐t tß╗¦a m├Āu trß║»ng silver chloride (AgCl).
+ Khi X- l├Ā Br- th├¼ xuß║źt hiß╗ćn kß║┐t tß╗¦a m├Āu v├Āng nhß║Īt silver bromide (AgBr).
+ Khi X- l├Ā I- th├¼ xuß║źt hiß╗ćn kß║┐t tß╗¦a m├Āu v├Āng silver iodide (AgI).
- Vß╗øi c├Īc hiß╗ćn tŲ░ß╗Żng kh├Īc nhau nhŲ░ tr├¬n, ngŲ░ß╗Øi ta d├╣ng dung dß╗ŗch silver nitrate ─æß╗ā ph├ón biß╗ćt c├Īc ion halide.

H├¼nh 18.2. Mß╗Öt sß╗æ hß╗Żp chß║źt silver halide
|
- Khi phß║Żn ß╗®ng vß╗øi sulfuric acid ─æß║Ęc, Cl- kh├┤ng thß╗ā hiß╗ćn t├Łnh khß╗Ł, Br- thß╗ā hiß╗ćn t├Łnh khß╗Ł nhß╗»ng yß║┐u hŲĪn. - C├│ thß╗ā ph├ón biß╗ćt c├Īc ion halide X- trong dung dß╗ŗch bß║▒ng silver nitrate. |
|---|
B├Āi tß║Łp minh hß╗Źa
B├Āi 1: Khi h├▓a tan mß╗Śi hydrogen halide HF, HCl, HBr v├Ā HI v├Āo nŲ░ß╗øc th├¼ thu ─æŲ░ß╗Żc c├Īc dung dß╗ŗch hydrohalic acid. Dung dß╗ŗch n├Āo c├│ t├Łnh acid yß║┐u nhß║źt? V├¼ sao?
HŲ░ß╗øng dß║½n giß║Żi
- T├Łnh acid phß╗ź thuß╗Öc v├Āo khß║Ż n─āng t├Īch H cß╗¦a acid. Ph├ón tß╗Ł n├Āo c├Āng dß╗ģ t├Īch H th├¼ t├Łnh acid c├Āng mß║Īnh
- Trong nh├│m halogen, tß╗½ F ─æß║┐n I c├│ ─æß╗Ö ├óm ─æiß╗ćn giß║Żm dß║¦n
ŌåÆ Khß║Ż n─āng li├¬n kß║┐t H-X giß║Żm dß║¦n
ŌåÆ Khß║Ż n─āng t├Īch H trong HX t─āng dß║¦n
ŌåÆ T├Łnh acid t─āng dß║¦n
ŌåÆ Dung dß╗ŗch HF c├│ t├Łnh acid yß║┐u nhß║źt
B├Āi 2: ─Éiß╗ćn ph├ón n├│ng chß║Ży mß╗Öt muß╗æi 11,7g halogenua NaX ngŲ░ß╗Øi ta thu ─æŲ░ß╗Żc 2,24 l├Łt kh├Ł (─æktc).
a) X├Īc ─æß╗ŗnh nguy├¬n tß╗æ X ?
b) T├Łnh thß║┐ t├Łch kh├Ł HX thu ─æŲ░ß╗Żc khi cho X t├Īc dß╗źng vß╗øi 4,48 l├Łt H2 ß╗¤ ─æktc ?
c) T├Łnh tß╗Ę lß╗ć % c├Īc kh├Ł sau phß║Żn ß╗®ng ?
HŲ░ß╗øng dß║½n giß║Żi
PTHH: 2NaX ŌåÆ 2Na + X2
a, nX2 = 0,1 mol ŌćÆ nNaX = 2. 0,1 = 0,2 mol.
MNaX = 11,7/0,2 = 58,5 ŌćÆ X = 35,5 (Cl)
b, X2 + H2 ŌåÆ 2HX
nH2 = 0,2 mol ŌćÆ nHX = 2. nX2= 0,2 mol (H2 dŲ░)
ŌćÆ VHX = 0,2.22,4 = 4,48 l
c, Sau phß║Żn ß╗®ng c├│ 0,2 mol kh├Ł HCl v├Ā 0,1 mol H2 dŲ░
%HCl= 0,2/(0,2 + 0,1)= 66,67%
ŌćÆ %H2 = 33,33%
B├Āi 3: Cho d├Ży c├Īc chß║źt sau, chß║źt n├Āo c├│ khß║Ż n─āng t├Īc dß╗źng ─æŲ░ß╗Żc vß╗øi axit HCl? Viß║┐t phŲ░ŲĪng tr├¼nh h├│a hß╗Źc cß╗¦a phß║Żn ß╗®ng xß║Ży ra, ghi r├Ą ─æiß╗üu kiß╗ćn cß╗¦a phß║Żn ß╗®ng: Fe, FeCl2 , FeO, Fe2 O3 , Fe3 O4 , KMnO4 , Cu, AgNO3 , H2 SO4 , Mg(OH) 2 .
HŲ░ß╗øng dß║½n giß║Żi
C├Īc chß║źt c├│ thß╗ā t├Īc dß╗źng vß╗øi axit HCl l├Ā: Fe, FeO, Fe2 O3 , Fe3 O4 , KMnO4 , AgNO3 , Mg(OH) 2 .
PTHH:
Fe + 2HCl ŌåÆ FeCl2 + H2
FeO + 2HCl ŌåÆ FeCl2 + H2 O
Fe2 O3 + 6HCl ŌåÆ 2FeCl3 + 3H2 O
Fe3 O4 + 8HCl ŌåÆ FeCl2 +2FeCl3 + 4H2 O
2KMnO4 + 16HCl ŌåÆ 2KCl + 2MnCl2 + 5Cl2 + 8H2 O
AgNO3 + HCl ŌåÆ AgCl + HNO3
Luyß╗ćn tß║Łp B├Āi 18 H├│a 10 C├Īnh Diß╗üu
Hß╗Źc xong b├Āi hß╗Źc n├Āy, em c├│ thß╗ā:
- Nhß║Łn x├®t (tß╗½ bß║Żng dß╗» liß╗ću vß╗ü nhiß╗ćt ─æß╗Ö s├┤i) v├Ā giß║Żi th├Łch ─æŲ░ß╗Żc xu hŲ░ß╗øng biß║┐n ─æß╗Ģi nhiß╗ćt ─æß╗Ö s├┤i cß╗¦a c├Īc hydrogen halide tß╗½ HCl tß╗øi HI dß╗▒a v├Āo tŲ░ŲĪng t├Īc van der Waals.
- Giß║Żi th├Łch ─æŲ░ß╗Żc sß╗▒ bß║źt thŲ░ß╗Øng vß╗ü nhiß╗ćt ─æß╗Ö s├┤i cß╗¦a HF so vß╗øi c├Īc HX kh├Īc.
- Tr├¼nh b├Āy ─æŲ░ß╗Żc xu hŲ░ß╗øng biß║┐n ─æß╗Ģi t├Łnh acid cß╗¦a d├Ży hydrohalic acid.
- Thß╗▒c hiß╗ćn ─æŲ░ß╗Żc th├Ł nghiß╗ćm ph├ón biß╗ćt c├Īc ion F-, Cl-, Br- ,I- bß║▒ng c├Īch cho dung dß╗ŗch silver nitrate v├Āo dung dß╗ŗch muß╗æi cß╗¦a ch├║ng.
- Tr├¼nh b├Āy ─æŲ░ß╗Żc t├Łnh kh├Ł cß╗¦a c├Īc ion halide (Cl-, Br-, I- ) th├┤ng qua phß║Żn ß╗®ng vß╗øi chß║źt oxi ho├Ī l├Ā sulfuric acid ─æß║Ęc.
- N├¬u ─æŲ░ß╗Żc ß╗®ng dß╗źng cß╗¦a mß╗Öt sß╗æ hydrogen halide.
3.1. Trß║»c nghiß╗ćm B├Āi 18 H├│a 10 C├Īnh Diß╗üu
C├Īc em c├│ thß╗ā hß╗ć thß╗æng lß║Īi nß╗Öi dung kiß║┐n thß╗®c ─æ├Ż hß╗Źc ─æŲ░ß╗Żc th├┤ng qua b├Āi kiß╗ām tra Trß║»c nghiß╗ćm H├│a hß╗Źc 10 C├Īnh Diß╗üu B├Āi 18 cß╗▒c hay c├│ ─æ├Īp ├Īn v├Ā lß╗Øi giß║Żi chi tiß║┐t.
-
- A. 45,45%
- B. 54,55%
- C. 66,67%
- D. 33,33%
-
- A. 6,67%
- B. 5,95%
- C. 11,9%
- D. 8,76%
-
- A. (1), (2).
- B. (3), (4).
- C. (5), (6).
- D. (3), (6).
C├óu 4-10: Mß╗Øi c├Īc em ─æ─āng nhß║Łp xem tiß║┐p nß╗Öi dung v├Ā thi thß╗Ł Online ─æß╗ā cß╗¦ng cß╗æ kiß║┐n thß╗®c vß╗ü b├Āi hß╗Źc n├Āy nh├®!
3.2. B├Āi tß║Łp SGK B├Āi 18 H├│a 10 C├Īnh Diß╗üu
C├Īc em c├│ thß╗ā xem th├¬m phß║¦n hŲ░ß╗øng dß║½n Giß║Żi b├Āi tß║Łp H├│a hß╗Źc 10 C├Īnh Diß╗üu B├Āi 18 ─æß╗ā gi├║p c├Īc em nß║»m vß╗»ng b├Āi hß╗Źc v├Ā c├Īc phŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp.
Giß║Żi c├óu hß╗Åi 1 trang 109 SGK H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi c├óu hß╗Åi 2 trang 109 SGK H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi c├óu hß╗Åi 3 trang 111 SGK H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Luyß╗ćn tß║Łp 1 trang 111 SGK H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Vß║Łn dß╗źng trang 112 SGK H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Thß╗▒c h├Ānh trang 113 SGK H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Luyß╗ćn tß║Łp 2 trang 113 SGK H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 1 trang 114 SGK H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 2 trang 114 SGK H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 3 trang 114 SGK H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 4 trang 114 SGK H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 18.1 trang 62 SBT H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 18.2 trang 62 SBT H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 18.3 trang 63 SBT H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 18.4 trang 63 SBT H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 18.5 trang 63 SBT H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 18.6 trang 64 SBT H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 18.7 trang 64 SBT H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 18.8 trang 64 SBT H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 18.9 trang 64 SBT H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 18.10 trang 65 SBT H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 18.11 trang 65 SBT H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 18.12 trang 65 SBT H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 18.13 trang 65 SBT H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 18.14 trang 65 SBT H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 18.15 trang 65 SBT H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 18.16 trang 66 SBT H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Giß║Żi b├Āi 18.17 trang 66 SBT H├│a hß╗Źc 10 C├Īnh Diß╗üu - CD
Hß╗Åi ─æ├Īp B├Āi 18 H├│a hß╗Źc 10 C├Īnh Diß╗üu
Trong qu├Ī tr├¼nh hß╗Źc tß║Łp nß║┐u c├│ thß║»c mß║»c hay cß║¦n trß╗Ż gi├║p g├¼ th├¼ c├Īc em h├Ży comment ß╗¤ mß╗źc Hß╗Åi ─æ├Īp, Cß╗Öng ─æß╗ōng H├│a hß╗Źc HOC247 sß║Į hß╗Ś trß╗Ż cho c├Īc em mß╗Öt c├Īch nhanh ch├│ng!
Ch├║c c├Īc em hß╗Źc tß║Łp tß╗æt v├Ā lu├┤n ─æß║Īt th├Ānh t├Łch cao trong hß╗Źc tß║Łp!







