Mß╗Øi c├Īc em hß╗Źc sinh c├╣ng theo d├Ąi nß╗Öi dung b├Āi hß╗Źc Th├Ānh phß║¦n cß╗¦a nguy├¬n tß╗Ł m├┤n Ho├Ī hß╗Źc 10 chŲ░ŲĪng tr├¼nh SGK Kß║┐t nß╗æi tri thß╗®c ─æŲ░ß╗Żc tß║Łp thß╗ā gi├Īo vi├¬n HOC247 bi├¬n soß║Īn v├Ā tß╗Ģng hß╗Żp b├¬n dŲ░ß╗øi ─æ├óy sß║Į gi├║p c├Īc em hß╗Źc sinh trß║Ż lß╗Øi c├Īc c├óu hß╗Åi sau: Nguy├¬n tß╗Ł gß╗ōm c├Īc loß║Īi hß║Īt cŲĪ bß║Żn n├Āo? C├Īc nh├Ā khoa hß╗Źc ─æ├Ż ph├Īt hiß╗ćn ra c├Īc loß║Īi hß║Īt cŲĪ bß║Żn ─æ├│ nhŲ░ thß║┐ n├Āo?
T├│m tß║»t l├Į thuyß║┐t
1.1. C├Īc loß║Īi hß║Īt cß║źu tß║Īo n├¬n nguy├¬n tß╗Ł
- N─ām 1897, J, J, Thomson (T├┤m-xŲĪn, ngŲ░ß╗Øi Anh) thß╗▒c hiß╗ćn th├Ł nghiß╗ćm ph├│ng ─æiß╗ćn qua kh├┤ng kh├Ł lo─āng ─æ├Ż ph├Īt hiß╗ćn ra ch├╣m tia ph├Īt ra tß╗½ cß╗▒c ß║źm v├Ā bß╗ŗ h├║t lß╗ćch vß╗ü ph├Ła cß╗▒c dŲ░ŲĪng cß╗¦a ─æiß╗ćn trŲ░ß╗Øng, chß╗®ng tß╗Å ch├║ng mang ─æiß╗ćn t├Łch ├óm (xem h├¼nh 1.1). ─É├│ ch├Łnh l├Ā ch├╣m c├Īc hß║Īt electron. Electron l├Ā mß╗Öt th├Ānh phß║¦n cß╗¦a nguy├¬n tß╗Ł.
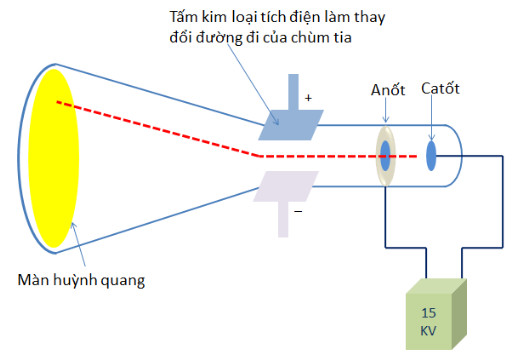
H├¼nh 1.1. Th├Ł nghiß╗ćm ph├Īt hiß╗ćn hß║Īt electron
- N─ām 1911E Rutherford (Ro-do-pho, ngŲ░ß╗Øi Niu Di-l├ón) thß╗▒c hiß╗ćn th├Ł nghiß╗ćm bß║»n ph├Ī l├Ī v├Āng rß║źt mß╗Ång bß║▒ng ch├╣m hß║Īt \(\alpha *\)) (alpha) (H├¼nh 1.2). ├öng sß╗Ł dß╗źng m├Ān huß╗│nh quang bao quanh l├Ī v├Āng ─æß╗ā quan s├Īt vß╗ŗ tr├Ł va chß║Īm cß╗¦a hß║Īt \(\alpha \). Kß║┐t quß║Ż th├Ł nghiß╗ćm cho thß║źy hß║¦u hß║┐t c├Īc hß║Īt a ─æß╗üu xuy├¬n thß║│ng qua l├Ī v├Āng, chß╗®ng tß╗Å nguy├¬n tß╗Ł c├│ cß║źu tß║Īo rß╗Śng, ß╗¤ t├óm chß╗®a mß╗Öt hß║Īt nh├ón mang ─æiß╗ćn t├Łch dŲ░ŲĪng v├Ā c├│ k├Łch thŲ░ß╗øc rß║źt nhß╗Å so vß╗øi k├Łch thŲ░ß╗øc nguy├¬n tß╗Ł.

H├¼nh 1.2. Th├Ł nghiß╗ćm ph├Īt hiß╗ćn hß║Īt nh├ón nguy├¬n tß╗Ł
- N─ām 1918, E. Rutherford v├Ā c├Īc cß╗Öng sß╗▒ khi d├╣ng hß║Īt g bß║»n ph├Ī nitrogen ─æ├Ż ph├Īt hiß╗ćn ra hß║Īt proton.
- N─ām 1918, E. Rutherford v├Ā c├Īc cß╗Öng sß╗▒ khi d├╣ng hß║Īt a bß║»n ph├Ī nitrogen ─æ├Ż ph├Īt hiß╗ćn ra hß║Īt proton. N─ām 1932, J. Chadwick (Chat-u├Įch, ngŲ░ß╗Øi Anh), c├┤ng sß╗▒ cß╗¦a Rutherford, ─æ├Ż ph├Īt hiß╗ćn ra hß║Īt neutron khi bß║»n ph├Ī beryllium bß║▒ng c├Īc hß║Īt c.
- Proton, neutron v├Ā electron l├Ā c├Īc hß║Īt cß║źu tß║Īo n├¬n nguy├¬n tß╗Ł.
* Th├Ānh phß║¦n cß║źu tß║Īo cß╗¦a nguy├¬n tß╗Ł gß╗ōm:
- Hß║Īt nh├ón (nucleus): ß╗¤ t├óm cß╗¦a nguy├¬n tß╗Ł, chß╗®a c├Īc proton mang ─æiß╗ćn t├Łch dŲ░ŲĪng v├Ā c├Īc neutron kh├┤ng mang ─æiß╗ćn.
- Vß╗Å nguy├¬n tß╗Ł chß╗®a c├Īc electron mang ─æiß╗ćn t├Łch ├óm, chuyß╗ān ─æß╗Öng rß║źt nhanh xung quanh hß║Īt nh├ón
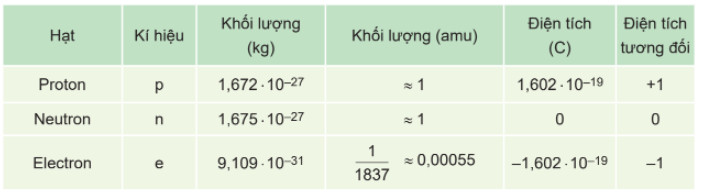
Bß║Żng 1.1. Khß╗æi lŲ░ß╗Żng, ─æiß╗ćn t├Łch cß╗¦a c├Īc loß║Īi hß║Īt cß║źu tß║Īo n├¬n nguy├¬n tß╗Ł
- Trong nguy├¬n tß╗Ł, sß╗æ proton bß║▒ng sß╗æ electron n├¬n nguy├¬n tß╗Ł trung ho├Ā ─æiß╗ćn.
- Khß╗æi lŲ░ß╗Żng cß╗¦a electron rß║źt nhß╗Å, kh├┤ng ─æ├Īng kß╗ā so vß╗øi khß╗æi lŲ░ß╗Żng cß╗¦a proton hay neutron n├¬n khß╗æi lŲ░ß╗Żng cß╗¦a nguy├¬n tß╗Ł tß║Łp trung hß║¦u hß║┐t ß╗¤ hß║Īt nh├ón.
| - Nguy├¬n tß╗Ł v├┤ c├╣ng nhß╗Å nhŲ░ng ─æŲ░ß╗Żc tß║Īo th├Ānh tß╗½ c├Īc hß║Īt nhß╗Å hŲĪn, gß╗ōm hß║Īt nh├ón (chß╗®a proton mang ─æiß╗ćn t├Łch dŲ░ŲĪng v├Ā neutron kh├┤ng mang ─æiß╗ćn) v├Ā vß╗Å nguy├¬n tß╗Ł (chß╗®a c├Īc electron mang ─æiß╗ćn t├Łch ├óm). Nguy├¬n tß╗½ trung ho├Ā vß╗ü ─æiß╗ćn v├¼ c├│ sß╗æ proton bß║▒ng sß╗æ electron. |
|---|
1.2. K├Łch thŲ░ß╗øc v├Ā khß╗æi lŲ░ß╗Żng cß╗¦a nguy├¬n tß╗Ł
a. K├Łch thŲ░ß╗øc
- K├Łch thŲ░ß╗øc cß╗¦a nguy├¬n tß╗Ł l├Ā khoß║Żng kh├┤ng gian tß║Īo bß╗¤i sß╗▒ chuyß╗ān ─æß╗Öng cß╗¦a c├Īc electron. C├Īc nguy├¬n tß╗Ł kh├Īc nhau c├│ sß╗æ electron kh├Īc nhau n├¬n c├│ k├Łch thŲ░ß╗øc nhau. Nß║┐u coi nguy├¬n tß╗Ł nhŲ░ mß╗Öt khß╗æi cß║¦u th├¼ ─æŲ░ß╗Øng k├Łnh cß╗¦a n├│ chß╗ē khoß║Żng 10-10 m.
- K├Łch thŲ░ß╗øc nguy├¬n tß╗Ł rß║źt nhß╗Å n├¬n thŲ░ß╗Øng ─æŲ░ß╗Żc biß╗āu diß╗ģn bß║▒ng ─æŲĪn vß╗ŗ picomet (pm) hay Angstrom (\(\mathop A\limits^0 \)). 1 pm = 10-12 m, 1\(\mathop A\limits^0 \)= 10-10 m. Nguy├¬n tß╗Ł hydrogen c├│ c┼®ng chß╗®a sß╗æ nguy├¬n b├Īn k├Łnh khoß║Żng 53 pm,
- Hß║Īt nh├ón nguy├¬n tß╗Ł c├│ ─æŲ░ß╗Øng k├Łnh khoß║Żng 10-2 pm, k├Łch dung ─æŲ░ß╗Żc. V├Ł dß╗ź: trong thŲ░ß╗øc nhß╗Å hŲĪn nhiß╗üu so vß╗øi k├Łch thŲ░ß╗øc nguy├¬n tß╗Ł.
b. Khß╗æi lŲ░ß╗Żng
- Khß╗æi lŲ░ß╗Żng nguy├¬n tß╗Ł bß║▒ng tß╗Ģng khß╗æi lŲ░ß╗Żng c├Īc hß║Īt proton, neutron v├Ā electron c├│ trong nguy├¬n tß╗Ł. Khß╗æi lŲ░ß╗Żng nguy├¬n tß╗Ł rß║źt nhß╗Å n├¬n mß╗Öt lŲ░ß╗Żng chß║źt rß║źt nhß╗Å c┼®ng chß╗®a tß╗øi h├Āng tß╗ē tß╗ē nguy├¬n tß╗Ł. V├Ł dß╗ź: Trong 2g carbon chß╗®a khoß║Żng 1023 nguy├¬n tß╗Ł carbon.
- C├│ thß╗ā biß╗āu thß╗ŗ khß╗æi lŲ░ß╗Żng nguy├¬n tß╗Ł theo ─æŲĪn vß╗ŗ khß╗æi lŲ░ß╗Żng nguy├¬n tß╗Ł, k├Ł hiß╗ću amu.
V├Ł dß╗ź: Mß╗Öt nguy├¬n tß╗Ł oxygen c├│ khß╗æi lŲ░ß╗Żng l├Ā 2,656.10-26 kg.
1 amu = 1,661.10-27 kg n├¬n khß╗æi lŲ░ß╗Żng mß╗Öt nguy├¬n tß╗Ł oxygen l├Ā 15,990 amu.
| - Khß╗æi lŲ░ß╗Żng nguy├¬n tß╗Ł tß║Łp trung ß╗¤ hß║Īt nh├ón (do khß╗æi lŲ░ß╗Żng cß╗¦a electron rß║źt nhß╗Å so vß╗øi khß╗æi lŲ░ß╗Żng cß╗¦a proton v├Ā neutron) |
|---|
1.3. ─Éiß╗ćn t├Łch hß║Īt nh├ón v├Ā sß╗æ khß╗æi
- Sß╗æ proton trong hß║Īt nh├ón nguy├¬n tß╗Ł bß║▒ng sß╗æ ─æŲĪn vß╗ŗ ─æiß╗ćn t├Łch hß║Īt nh├ón, k├Ł hiß╗ću l├Ā Z.
V├Ł dß╗ź: Hß║Īt nh├ón nguy├¬n tß╗Ł Na c├│ 11 proton n├¬n sß╗æ ─æŲĪn vß╗ŗ ─æiß╗ćn t├Łch hß║Īt nh├ón l├Ā Z= 11.
- Tß╗Ģng sß╗æ proton v├Ā neutron trong hß║Īt nh├ón cß╗¦a mß╗Öt nguy├¬n tß╗Ł ─æŲ░ß╗Żc gß╗Źi l├Ā sß╗æ khß╗æi (hay sß╗æ nucleon), k├Ł hiß╗ću l├Ā A.
A = Z + số neutron
V├Ł dß╗ź: Hß║Īt nh├ón nguy├¬n tß╗Ł Na c├│ sß╗æ proton l├Ā 11 v├Ā sß╗æ neutron l├Ā 12 n├¬n sß╗æ khß╗æi cß╗¦a hß║Īt nh├ón nguy├¬n tß╗Ł Na l├Ā:
A = 11 + 12 = 23
|
- Hß║Īt nh├ón nguy├¬n tß╗Ł c├│ k├Łch thŲ░ß╗øc v├┤ c├╣ng nhß╗Å so vß╗øi nguy├¬n tß╗Ł. |
|---|
B├Āi tß║Łp minh hß╗Źa
B├Āi 1: Nguy├¬n tß╗Ł gß╗ōm c├Īc loß║Īi hß║Īt cŲĪ bß║Żn n├Āo? C├Īc nh├Ā khoa hß╗Źc ─æ├Ż ph├Īt hiß╗ćn ra c├Īc loß║Īi hß║Īt cŲĪ bß║Żn ─æ├│ nhŲ░ thß║┐ n├Āo?
HŲ░ß╗øng dß║½n giß║Żi
- Nguy├¬n tß╗Ł gß╗ōm 3 loß║Īi hß║Īt cŲĪ bß║Żn: electron, proton, neutron
- Sß╗▒ ph├Īt hiß╗ćn ra c├Īc loß║Īi hß║Īt cŲĪ bß║Żn:
+ Electron: th├Ł nghiß╗ćm ph├│ng ─æiß╗ćn qua kh├┤ng kh├Ł lo├Żng ─æ├Ż ph├Īt hiß╗ćn ra ch├╣m tia ph├Īt ra tß╗½ cß╗▒c ├óm v├Ā bß╗ŗ h├║t lß╗ćch vß╗ü ph├Ła cß╗▒c dŲ░ŲĪng cß╗¦a ─æiß╗ćn trŲ░ß╗Øng ŌåÆ Ch├║ng mang ─æiß╗ćn t├Łch ├óm
+ Proton: d├╣ng hß║Īt alpha bß║»n ph├Ī nitrogen ─æ├Ż ph├Īt hiß╗ćn ra hß║Īt proton
+ Neutron: d├╣ng hß║Īt alpha bß║»n ph├Ī beryllium
B├Āi 2: Tß╗Ģng sß╗æ hß║Īt proton, nŲĪtron, electron trong nguy├¬n tß╗Ł X l├Ā 28, trong ─æ├│ sß╗æ hß║Īt kh├┤ng mang ─æiß╗ćn chiß║┐m xß║źp xß╗ē 35% tß╗Ģng sß╗æ hß║Īt. Sß╗æ hß║Īt mß╗Śi loß║Īi trong nguy├¬n tß╗Ł X l├Ā bao nhi├¬u ?
HŲ░ß╗øng dß║½n giß║Żi
- Tß╗Ģng sß╗æ hß║Īt proton, nŲĪtron, electron trong nguy├¬n tß╗Ł X l├Ā 28
ŌåÆ p + n + e = 28 ŌåÆ 2p + e = 28 (1)
- Sß╗æ hß║Īt kh├┤ng mang ─æiß╗ćn chiß║┐m xß║źp xß╗ē 35% tß╗Ģng sß╗æ hß║Īt
ŌåÆ n = 35% * (p + n + e) (2)
Thay (1) v├Āo (2) ŌåÆ n = 35% * 28 = 10 (hß║Īt)
ŌåÆ p = e = (28 ŌĆō 10) : 2 = 9
Vß║Ły trong nguy├¬n tß╗Ł X, sß╗æ p = sß╗æ e = 9; sß╗æ n = 10.
B├Āi 3: Nguy├¬n tß╗Ł Al c├│ b├Īn k├Łnh 1,43v├Ā c├│ nguy├¬n tß╗Ł khß╗æi l├Ā 27u. Khß╗æi lŲ░ß╗Żng ri├¬ng cß╗¦a Al bß║▒ng bao nhi├¬u, biß║┐t rß║▒ng trong tinh thß╗ā nh├┤m c├Īc nguy├¬n tß╗Ł chß╗ē chiß║┐m 74% thß╗ā t├Łch, c├▓n lß║Īi l├Ā c├Īc khe trß╗æng?
HŲ░ß╗øng dß║½n giß║Żi
rnguy├¬n tß╗Ł Al =\(1,43{\mkern 1mu} .{\mkern 1mu} {10^{ - 8}}\)
Vnguy├¬n tß╗Ł Al \(=\ \frac{4}{3}\,.3,14\,.\,{{(1,{{43.10}^{-8}})}^{3}}\)= 12,243.10-24 cm3
M nguy├¬n tß╗Ł Al \(=\,27\,.\,1,{{66.10}^{-24}}\,\,gam\)
d nguy├¬n tß╗Ł Al \(=\frac{M}{V}\)\(=\,\frac{27\,.\,1,{{66.10}^{-24}}}{12,{{243.10}^{-24}}}=3,66\,\,g/c{{m}^{3}}\)
Thß╗▒c tß║┐ Vnguy├¬n tß╗Ł chiß║┐m 74% thß╗ā t├Łch tinh thß╗ā. Vß║Ły d thß╗▒c tß║┐ cß╗¦a Al l├Ā :
\(\text{d = 3,66}\,.\,\frac{\text{74}}{\text{100}}\text{ = 2,7}\,\,\text{g/c}{{\text{m}}^{\text{3}}}\).
Luyß╗ćn tß║Łp B├Āi 1 H├│a 10 KNTT
Sau b├Āi hß╗Źc n├Āy, hß╗Źc sinh sß║Į:
- Tr├¼nh b├Āy ─æŲ░ß╗Żc th├Ānh phß║¦n cß╗¦a nguy├¬n tß╗Ł (nguy├¬n tß╗Ł v├┤ c├╣ng nhß╗Å; nguy├¬n tß╗Ł gß╗ōm 2 phß║¦n: hß║Īt nh├ón v├Ā lß╗øp vß╗Å nguy├¬n tß╗Ł; hß║Īt nh├ón tß║Īo n├¬n bß╗¤i c├Īc hß║Īt proton (p), neutron (n); lß╗øp vß╗Å tß║Īo n├¬n bß╗¤i c├Īc electron (e); ─æiß╗ćn t├Łch, khß╗æi lŲ░ß╗Żng mß╗Śi loß║Īi hß║Īt).
- So s├Īnh ─æŲ░ß╗Żc khß╗æi lŲ░ß╗Żng cß╗¦a electron vß╗øi proton v├Ā neutron, k├Łch thŲ░ß╗øc cß╗¦a hß║Īt nh├ón vß╗øi k├Łch thŲ░ß╗øc nguy├¬n tß╗Ł.
3.1. Trß║»c nghiß╗ćm B├Āi 1 H├│a 10 KNTT
C├Īc em c├│ thß╗ā hß╗ć thß╗æng lß║Īi nß╗Öi dung kiß║┐n thß╗®c ─æ├Ż hß╗Źc ─æŲ░ß╗Żc th├┤ng qua b├Āi kiß╗ām tra Trß║»c nghiß╗ćm H├│a hß╗Źc 10 KNTT B├Āi 1 cß╗▒c hay c├│ ─æ├Īp ├Īn v├Ā lß╗Øi giß║Żi chi tiß║┐t.
-
- A. proton v├Ā ╬▒.
- B. proton v├Ā neutron.
- C. proton v├Ā electron.
- D. electron v├Ā neutron.
-
- A. 1
- B. 2
- C. 3
- D. 4
-
- A. 1
- B. 2
- C. 3
- D. 4
C├óu 4-10: Mß╗Øi c├Īc em ─æ─āng nhß║Łp xem tiß║┐p nß╗Öi dung v├Ā thi thß╗Ł Online ─æß╗ā cß╗¦ng cß╗æ kiß║┐n thß╗®c vß╗ü b├Āi hß╗Źc n├Āy nh├®!
3.2. B├Āi tß║Łp SGK B├Āi 1 H├│a 10 KNTT
C├Īc em c├│ thß╗ā xem th├¬m phß║¦n hŲ░ß╗øng dß║½n Giß║Żi b├Āi tß║Łp H├│a hß╗Źc 10 KNTT B├Āi 1 ─æß╗ā gi├║p c├Īc em nß║»m vß╗»ng b├Āi hß╗Źc v├Ā c├Īc phŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp.
Giß║Żi c├óu hß╗Åi 1 trang 14 SGK H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi c├óu hß╗Åi 2 trang 14 SGK H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi c├óu hß╗Åi 3 trang 14 SGK H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi c├óu hß╗Åi 4 trang 15 SGK H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi c├óu hß╗Åi 5 trang 15 SGK H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi c├óu hß╗Åi 6 trang 16 SGK H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi c├óu hß╗Åi 7 trang 16 SGK H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 1.1 trang 4 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 1.2 trang 4 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 1.3 trang 4 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 1.4 trang 4 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 1.5 trang 5 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 1.6 trang 5 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 1.7 trang 5 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 1.8 trang 5 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 1.9 trang 5 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 1.10 trang 5 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 1.11 trang 5 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 1.12 trang 5 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 1.13 trang 5 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Hß╗Åi ─æ├Īp B├Āi 1 H├│a hß╗Źc 10 KNTT
Trong qu├Ī tr├¼nh hß╗Źc tß║Łp nß║┐u c├│ thß║»c mß║»c hay cß║¦n trß╗Ż gi├║p g├¼ th├¼ c├Īc em h├Ży comment ß╗¤ mß╗źc Hß╗Åi ─æ├Īp, Cß╗Öng ─æß╗ōng H├│a hß╗Źc HOC247 sß║Į hß╗Ś trß╗Ż cho c├Īc em mß╗Öt c├Īch nhanh ch├│ng!
Ch├║c c├Īc em hß╗Źc tß║Łp tß╗æt v├Ā lu├┤n ─æß║Īt th├Ānh t├Łch cao trong hß╗Źc tß║Łp!







