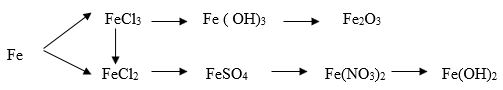Nhằm mục đích kiểm tra kiến thức cũng như cách vận dụng để giải bài tập, HOC247 xin giới thiệu đến các em học sinh nội dung Đề thi học sinh giỏi môn Hóa học 9- Trường THCS Lương Thế Vinh có đáp án dưới đây. Với các bài tập có phương pháp và lời giải chi tiết, hi vọng rằng đây sẽ là tài liệu giúp các em học tập tốt hơn.
TRƯỜNG THCS LƯƠNG THẾ VINH
ĐỀ THI HỌC SINH GIỎI CẤP TRƯỜNG
MÔN HÓA HỌC 9
THỜI GIAN: 150 PHÚT
Câu 1 (3,5 điểm)
Viết các phương trình phản ứng để thực hiện chuỗi biến hóa sau:
Chỉ từ các chất: KMnO4, BaCl2, H2SO4 và Fe có thể điều chế được các khí gì? Viết phương trình hóa học của các phản ứng tạo thành các khí đó.
Câu 2 (3,5 điểm).
1. Viết các phương trình phản ứng có thể xảy ra khi cho Al và Cl2 lần lượt tác dụng với H2O, dung dịch NaOH, dung dịch H2SO4 loãng. Trong các phản ứng đó, phản ứng nào có ứng dụng thực tế?
2. Cho 5,2 gam kim loại M tác dụng với axit H2SO4 loãng dư thu được 1,792 lít khí H2 (ở đktc). Xác định kim loại M.
Câu 3 (4,5 điểm).
- Không dùng thuốc thử nào khác hãy phân biệt các lọ dung dịch riêng biệt sau: MgCl2, NaOH, NH4Cl, H2SO4, KCl.
- Viết CTCT có thể có của hợp chất hữu cơ: C3H6; C2H6O.
Câu 4 (3,5 điểm). Hòa tan 7,83 gam một hỗn hợp gồm 2 kim loại kiềm A, B (nguyên tử khối của A nhỏ hơn nguyên tử khối của B) thuộc 2 chu kì kế tiếp của bảng hệ thống tuần hoàn các nguyên tố hóa học, thu được 2,8 lít khí H2 bay ra (điều kiện tiêu chuẩn).
1) Xác định kim loại A, B.
2) Cho 16,8 lit khí CO2 (điều kiện tiêu chuẩn) tác dụng hoàn toàn vào 600ml dung dịch AOH 2M thu được dung dịch X. Tính tổng khối lượng muối trong dung dịch X.
Câu 5 (3,0 điểm). Hỗn hợp A1 gồm Al2O3 và Fe2O3. Dẫn khí CO qua 21,1 gam A1 và nung nóng thu được hỗn hợp A2 gồm 5 chất rắn và hỗn hợp khí A3. Dẫn A3 qua dung dịch Ca(OH)2 dư thấy có 5 gam kết tủa. A2 tác dụng vừa đủ với 1 lít dung dịch H2SO4 0,5M thu được dung dịch A4 và có 2,24 lít khí thoát ra (đo ở đktc).
Tính % khối lượng mỗi chất trong hỗn hợp A1.
Câu 6 (2,0 điểm). Cho 23,8 gam hỗn hợp X (Cu, Fe, Al) tác dụng vừa đủ 14,56 lít khí Cl2 (đktc). Mặt khác cứ 0,25 Mol hỗn hợp tác dụng với dung dịch HCl dư thu được 0,2 Mol khí ( đktc). Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp X.
ĐÁP ÁN
|
Câu |
Nội dung |
Điểm |
||||||||||||||||||||||||||||||||||||||||||
|
1.1 2,5 Điểm |
2 Fe + 3 Cl2 → 2FeCl3 FeCl3 + 3NaOH → Fe (OH) 3+ 3NaCl 2Fe (OH) 3 → Fe2 O3 + 3H2O Fe + 2HCl → FeCl2 + H2 2FeCl3 + Fe →3 FeCl2 FeCl2 + Ag2 SO4 → 2 AgCl + FeSO4 FeSO4 + Ba ( NO3)2 → Fe ( NO3)2 + Ba SO4 Fe ( NO3)2 +2NaOH → Fe (OH)2 + 2NaNO3 |
0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ |
||||||||||||||||||||||||||||||||||||||||||
|
1.2 2,0 Điểm |
Có thể điều chế được các khí: O2, H2, SO2, HCl 2KMnO4 K2MnO4 + MnO2 + O2 H2SO4 loãng + Fe ® FeSO4 + H2 6H2SO4 (đặc, nóng) + 2Fe ® Fe2(SO4)3 + 6H2O + 3SO2 H2SO4 (đặc, nóng) + BaCl2 ® BaSO4¯ + 2HCl |
0,25 đ 0,25 đ 0,25 đ 0,25 đ |
||||||||||||||||||||||||||||||||||||||||||
|
2.1 1,5 Điểm |
Phương trình phản ứng: 2Al + 6H2O → 2Al(OH)3↓ + 3H2↑ (0,25đ) Cl2 + H2O → HCl + HClO (Điều chế nước clo) (0,5 đ) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑ (0,25đ) Cl2 + H2SO4 : không phản ứng 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (Điều chế H2) (0,5đ) Cl2 + 2NaOH → NaCl + NaOCl + H2O (Điều chế nước Javel)
|
0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ |
||||||||||||||||||||||||||||||||||||||||||
|
2.2 2,0 Điểm |
Gọi hoá trị của kim loại M là n . Ta có nH2 = 1,792/22,4 = 0,08mol 2M + nH2SO4 ® M2(SO4)n + nH2 2.0,08/n mol 0,08mol Theo bài ra ta có: 2.0,08/n. M = 5,2 Þ M = 32,5n . Ta có bảng sau:
Vậy nguyên tố cần tìm là Zn |
|
||||||||||||||||||||||||||||||||||||||||||
|
3.1 2,5 Điểm |
Lấy mỗi lọ một ít dung dịch để làm mẫu thử, mỗi lần nhỏ 1 dung dịch vào mẫu thử của 4 dung dịch còn lại, sau 5 lần thí nghiệm các hiện tượng đươc ghi nhận vào bảng kết quả sau:
* Kết quả: - Tạo kết tủa trắng, mẫu thử đó là MgCl2. (0,25đ) - Tạo kết tủa trắng và khí có mùi khai bay ra, mẫu thử đó là NaOH. (0,25đ) - Tạo khí có mùi khai, mẫu thử đó là NH4Cl. (0,25đ) - Còn 2 mẫu thử không có hiện tượng, lấy kết tủa Mg(OH)2 cho vào, mẫu thử nào làm tan kết tủa là H2SO4. (0,25đ) - Mẫu còn lại là KCl. (0,25đ) * Các phương trình phản ứng: MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl (0,25đ) NH4Cl + NaOH → NaCl + NH3↑ + H2O (0,25đ) Mg(OH)2 + H2SO4 → MgSO4 + 2H2O * Nhận biết được 1 chất kèm biện luận đầy đủ được 0,5 điểm |
|
---Để xem đầy đủ nội dung và đáp án của đề thi các em vui lòng xem online hoặc tải về máy---
Trên đây là trích dẫn một phần nội dung tài liệu Đề thi học sinh giỏi môn Hóa học 9- Trường THCS Lương Thế Vinh có đáp án. Để xem thêm nhiều tài liệu tham khảo hữu ích khác các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Ngoài ra các em học sinh có thể tham khảo các tài liệu cùng chuyên mục:
- Đề thi học sinh giỏi môn Hóa học 9- Sở GD & ĐT Thái Bình có đáp án
- Đề thi học sinh giỏi môn Lịch sử 9- Phòng GD & ĐT Tam Dương có đáp án
Chúc các em học tốt!