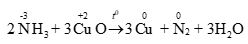Mời quý thầy cô cùng các em học sinh tham khảo Đề thi giữa học kì 2 môn Hoá 10 CTST năm 2022-2023 trường THPT Nguyễn Khuyến có đáp án. Đề thi bao gồm các câu hỏi trắc nghiệm và tự luận. Hy vọng bộ đề thi này sẽ giúp các em học sinh lớp 10 ôn tập hiệu quả và đạt điểm số cao trong kì thi giữa học kì 2 sắp tới.
|
TRƯỜNG THPT NGUYỄN KHUYẾN |
ĐỀ THI GIỮA HỌC KÌ 2 MÔN HÓA HỌC 10 NĂM HỌC 2022-2023 Thời gian làm bài: 45 phút |
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Trong phản ứng oxi hoá – khử, chất nhường electron được gọi là
A. chất khử.
B. chất oxi hoá.
C. acid.
D. base.
Câu 2: Trong hợp chất H2S, số oxi hóa của sulfur (lưu huỳnh) là
A. +2.
B. +3.
C. +5.
D. -2.
Câu 3: Nhận xét nào sau đây về số oxi hoá là không đúng?
A. Số oxi hoá của một nguyên tử nguyên tố trong hợp chất là điện tích của nguyên tử nguyên tố đó với giả định đây là hợp chất ion.
B. Số oxi hoá của nguyên tử nguyên tố trong đơn chất bằng 0.
C. Số oxi hoá của oxygen luôn là -2.
D. Số oxi hoá của các kim loại kiềm trong hợp chất luôn là +1.
Câu 4: Số oxi hóa của nitrogen trong NO3- là
A. +6.
B. +5.
C. +4.
D. +3.
Câu 5: Cho phản ứng: SO2 + Br2 + H2O → HBr + H2SO4. Trong phản ứng trên, vai trò của Br2
A. là chất oxi hóa
B. là chất khử.
C. vừa là chất oxi hóa, vừa là chất tạo môi trường.
D. vừa là chất khử, vừa là chất tạo môi trường.
Câu 6: Số oxi hoá của Al trong NaAlH4 là
A. +2.
B. +3.
C. -3.
D. +5.
Câu 7: Chlorine vừa đóng vai trò chất oxi hóa, vừa đóng vai trò chất khử trong phản ứng nào sau đây?
A. 2Fe + 3Cl2 → 2FeCl3
B. H2 + Cl2 → 2HCl
C. 2FeCl2 + Cl2 → 2FeCl3
D. KOH + Cl2 → KCl + KClO + H2O
Câu 8: Trong các phản ứng hoá học sau, phản ứng oxi hoá – khử là
A. Ca(OH)2 + CuCl2 → Cu(OH)2↓ + CaCl2
B. Ca + Cl2 → CaCl2.
C. 3CaCl2 + 2K3PO4 → Ca3(PO4)2 + 6KCl.
D. CaO + 2HCl → CaCl2 + H2O.
Câu 9: Nhóm nào sau đây gồm các chất vừa có tính oxi hoá, vừa có tính khử?
A. Cl2, Al.
B. K, FeO.
C. H2SO4, F2.
D. SO2, FeO.
Câu 10: Trong phản ứng tạo thành magnesium chloride từ đơn chất: Mg + Cl2 → MgCl2.
Kết luận nào sau đây đúng?
A. Mỗi nguyên tử magnesium nhận 2e.
B. Mỗi nguyên tử chlorine nhận 2e.
C. Mỗi phân tử chlorine nhường 2e.
D. Mỗi nguyên tử magnesium nhường 2e.
Câu 11: Cho phản ứng: FeO + HNO3 → Fe(NO3)3 + NO + H2O. Trong phản ứng này có bao nhiêu phân tử HNO3 đóng vai trò là chất oxi hóa?
A. 1.
B. 4.
C. 8.
D. 10.
Câu 12: Copper(II) oxide (CuO) bị khử bởi ammonia (NH3) theo phản ứng sau:
NH3 + CuO → Cu + N2 + H2O
Tổng hệ số cân bằng (là số nguyên, tối giản) của chất tham gia phản ứng là
A. 5.
B. 12.
C. 13.
D. 14.
Câu 13: Cho phương trình hóa học:
aZn + bH2SO4 (đặc) → cZnSO4 + dH2S + fH2O.
Giá trị của b trong phương trình hóa học trên là
A. 5.
B. 4.
C. 3.
D. 2.
Câu 14: Cho 8,4 gam Fe phản ứng hoàn toàn với lượng dư dung dịch HNO3, thể tích khí NO (đkc) thu được là (coi NO là sản phẩm khử duy nhất)
A. 2,2400 lít.
B. 3,3600 lít.
C. 3,7185 lít .
D. 5,6360 lít.
Câu 15: Cho các phản ứng sau:
(1) Phản ứng trung hoà acid – base: HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l).
(2) Phản ứng nung vôi: CaCO3(s) → CaO(s) + CO2(g).
Nhận xét nào sau đây là đúng?
A. Cả hai phản ứng đều toả nhiệt.
B. Cả hai phản ứng đều thu nhiệt.
C. Phản ứng (1) thu nhiệt, phản ứng (2) toả nhiệt.
D. Phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt.
Câu 16: Những ngày nóng nực, pha viên sủi vitamin C vào nước để giải khát, khi viên sủi tan, thấy nước trong cốc mát hơn đó là do
A. xảy ra phản ứng tỏa nhiệt.
B. xảy ra phản ứng thu nhiệt.
C. xảy ra phản ứng trao đổi chất với môi trường.
D. có sự giải phóng nhiệt lượng ra ngoài môi trường.
Câu 17: Phát biểu nào sau đây không đúng?
A. Các phản ứng cháy thường là phản ứng tỏa nhiệt.
B. Phản ứng càng tỏa ra nhiều nhiệt càng dễ tự xảy ra.
C. Các phản ứng phân hủy thường là phản ứng thu nhiệt.
D. Các phản ứng khi đun nóng đều dễ xảy ra hơn.
Câu 18: Ở điều kiện chuẩn. Khi phản ứng thu nhiệt thì
A.\({\Delta _r}H_{298}^0 > 0\)
B.\({\Delta _r}H_{298}^0 = 0\)
C.\({\Delta _r}H_{298}^0 < 0\)
D.\({\Delta _r}H_{298}^0 \ge 0\)
Câu 19: Enthalpy tạo thành chuẩn của một đơn chất bền là
A. biến thiên enthalpy chuẩn của phản ứng giữa đơn chất đó với hydrogen.
B. là biến thiên enthalpy chuẩn của phản ứng giữa đơn chất đó với oxygen.
C. bằng 0.
D. được xác định từ nhiệt độ nóng chảy của nguyên tố đó.
Câu 20: Biết phản ứng đốt cháy khí carbon monoxide (CO) như sau:
CO (g) + O2 (g) ⟶ CO2 (g) \({\Delta _r}H_{298}^0 = - 283,0kJ\)
Ở điều kiện chuẩn, nếu đốt cháy hoàn toàn 2,479 L khí CO thì nhiệt lượng toả ra là bao nhiêu?
A. 283 kJ.
B. 28,3 kJ.
C. -283 kJ.
D. -28,3 kJ.
Câu 21: Phản ứng chuyển hoá giữa hai dạng đơn chất của phosphorus (P):
P (s, đỏ) ⟶ P (s, trắng) \({\Delta _r}H_{298}^o = 17,6kJ\)
Điều này chứng tỏ phản ứng:
A. thu nhiệt, P đỏ bền hơn P trắng.
B. thu nhiệt, P trắng bền hơn P đỏ.
C. toả nhiệt, P đỏ bền hơn P trắng.
D. toả nhiệt, P trắng bền hơn P đỏ.
Câu 22: Xét phản ứng đốt cháy methane:
CH4(g) + 2O2(g) ⟶ CO2(g) + 2H2O(l) \({\Delta _r}H_{298}^o\) = – 890,3 kJ
Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là – 393,5 và – 285,8 kJ/mol. Nhiệt tạo thành chuẩn của khí methane là
A. – 74,8 kJ.
B. 74,8 kJ.
C. – 211,6 kJ.
D. 211,6 kJ.
Câu 23: Cho phản ứng hóa học xảy ra ở điều kiện chuẩn sau:
2NO2(g) (đỏ nâu) → N2O4(g) (không màu)
Biết NO2 và N2O4 có \({\Delta _r}H_{298}^o\) tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
A. tỏa nhiệt, N2O4 bền vững hơn NO2.
B. thu nhiệt, N2O4 bền vững hơn NO2.
C. tỏa nhiệt, NO2 bền vững hơn N2O4.
D. thu nhiệt, NO2 bền vững hơn N2O4.
Câu 24: Cho phản ứng hydrogen hóa ethylene sau:
H2C=CH2(g) + H2(g) → H3C-CH3(g)
Biết năng lượng trung bình các liên kết trong các chất cho trong bảng sau:
|
Liên kết |
Eb (kJ/mol) |
Liên kết |
Eb (kJ/mol) |
|
C=C |
612 |
C-C |
346 |
|
C-H |
418 |
H-H |
436 |
Biến thiên enthalpy (kJ) của phản ứng có giá trị là
A. 134.
B. -134.
C. 478.
D. 284.
Câu 25: Công thức tính biến thiên enthalpy của phản ứng theo năng lượng liên kết là
A. \({{\Delta }_{r}}H_{298}^{0}=\Sigma {{E}_{b}}\left( cd \right)+\Sigma {{E}_{b}}\left( sp \right).\)
B. \({{\Delta }_{r}}H_{298}^{0}=\Sigma {{E}_{b}}\left( cd \right)-\Sigma {{E}_{b}}\left( sp \right).\)
C. \({{\Delta }_{r}}H_{298}^{0}=\Sigma {{E}_{b}}\left( sp \right)-\Sigma {{E}_{b}}\left( cd \right).\)
D. \({{\Delta }_{f}}H_{298}^{0}=\Sigma {{E}_{b}}\left( sp \right)-\Sigma {{E}_{b}}\left( cd \right).\)
Câu 26: Cho phản ứng sau:
\(CO\left( g \right) + C{l_2}\left( g \right)\mathop \to \limits^{than\,hoat\,tinh} COC{l_2}\left( g \right)\,{\Delta _r}H_{298}^o\, = \, - 105\,kJ\)
Biết ở điều kiện chuẩn: Eb(Cl-Cl) = 243 kJ/mol; Eb(C-Cl) = 339 kJ/mol; Eb(C=O) = 745 kJ/mol. Giá trị Eb(C ≡ O) là
A. 1075 kJ/ mol.
B. 105 kJ/ mol.
C. 150 kJ/ mol.
D. 107,5 kJ/ mol.
Câu 27: Phát biểu nào sau đây về nhiệt tạo thành là không đúng?
A. Enthalpy tạo thành chuẩn của một chất là lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn.
B. Nhiệt tạo thành chuẩn là nhiệt tạo thành ở điều kiện chuẩn.
C. Enthalpy tạo thành chuẩn của các đơn chất ở dạng bền vững nhất bằng 0.
D. Kí hiệu nhiệt tạo thành chuẩn là \({\Delta _r}H_{298}^o\)
Câu 28: Điều kiện nào sau đây không phải là điều kiện chuẩn?
A. Áp suất 1 bar và nhiệt độ 25oC hay 298K.
B. Áp suất 1 bar và nhiệt độ 298K.
C. Áp suất 1 bar và nhiệt độ 25K.
D. Áp suất 1 bar và nhiệt độ 25oC.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Dẫn khí SO2 vào 100 mL dung dịch KMnO4 0,02M đến khi dung dịch vừa mất màu tím.
Phản ứng xảy ra theo sơ đồ sau:
SO2 + KMnO4 + H2O → H2SO4 + K2SO4 + MnSO4
a) Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron và chỉ rõ chất khử, chất oxi hoá.
b) Xác định thể tích khí SO2 đã tham gia phản ứng ở điều kiện chuẩn.
Câu 2 (1 điểm): Cho enthalpy tạo thành chuẩn của các chất sau:
|
Chất |
H2O2(l) |
H2O(l) |
O2(g) |
|
\({\Delta _r}H_{298}^o\) (kJ/ mol) |
- 187,6 |
-285,8 |
0 |
Giải thích tại sao ở điều kiện chuẩn, H2O2(l) kém bền, dễ dàng phân huỷ thành H2O(l) và O2(g). Ngược lại, H2O(l) lại rất bền trong tự nhiên.
Câu 3 (1 điểm): Ammonia thường được tổng hợp từ nitrogen và hydrogen bằng quy trình Haber−Bosch:
N2 (g) + 3H2 (g) ⇄ 2NH3 (g) \({\Delta _r}H_{298}^o = - 93kJ.\)
a) Biết các giá trị năng lượng liên kết sau: EN ≡ N = 945 kJ mol-1; EH – H = 436 kJ mol-1. Tính EN– H.
b) Tính enthalpy tạo thành chuẩn của NH3 (g).
Đáp án đề thi Giữa học kì 2 môn Hóa học lớp 10 Cánh diều - Đề số 1
Phần I: Trắc nghiệm
|
1 - A |
2 - D |
3 - C |
4 - B |
5 - A |
6 - B |
7 - D |
8 - B |
9 - D |
10 - D |
|
11 - A |
12 - A |
13 - B |
14 - C |
15 - D |
16 - B |
17 - D |
18 - A |
19 - C |
20 - B |
|
21 - B |
22 - A |
23 - A |
24 - B |
25 - B |
26 - A |
27 - D |
28 - C |
|
|
Câu 4:
Số oxi hóa của O là -2; đặt số oxi hóa của N là x, ta có:
x + 3. (-2) = -1 ⇒ x = +5.
Câu 11:
Ta có:
.png?enablejsapi=1)
Phương trình hóa học:
\({\rm{3}}\mathop {{\rm{Fe}}}\limits^{{\rm{ + 2}}} {\rm{O}}\; + \;10{\mathop{\rm H}\nolimits} \mathop N\limits^{ + 5} O_3^{}\mathop \to \limits^{{t^0}} {\rm{3}}\mathop {{\rm{Fe}}}\limits^{{\rm{ + 3}}} {\rm{(NO}}_{\rm{3}}^{}{\rm{)}}_{\rm{3}}^{}\; + {\rm{2NO}} \uparrow + \;5{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
Có 10 phân tử HNO3 tham gia phản ứng, trong đó có 1 phân tử HNO3 đóng vai trò chất oxi hóa (bị khử thành NO), 9 phân tử HNO3 đóng vai trò môi trường.
Câu 12:
Ta có:
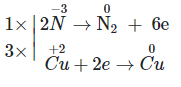
Phương trình hóa học:
Tổng hệ số cân bằng (là số nguyên, tối giản) của chất tham gia phản ứng là: 2 + 3 = 5.
Câu 13:
\({\rm{a}}\mathop {{\rm{Zn}}}\limits^{\rm{0}} \,{\rm{ + b}}{{\rm{H}}_{\rm{2}}}\mathop {\rm{S}}\limits^{{\rm{ + 6}}} {{\rm{O}}_{\rm{4}}}_{{\rm{dac}}\,} \to \,{\rm{c}}\mathop {{\rm{Zn}}}\limits^{{\rm{ + 2}}} {\rm{S}}{{\rm{O}}_{\rm{4}}}\,{\rm{ + }}\,{\rm{d}}{{\rm{H}}_{\rm{2}}}\mathop {\rm{S}}\limits^{{\rm{ - 2}}} \,{\rm{ + }}\,{\rm{f}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
Quá trình nhường – nhận e:
Phương trình hóa học:
4Zn + 5H2SO4(đặc) → 4ZnSO4 + H2S + 4H2O.
⇒ Giá trị của b trong phương trình hóa học trên là 5.
Câu 14:Gọi nNO = a (mol), ta có các quá trình:
\(nFe = \frac{{8,4}}{{56}} = 0,15(mol)\)
VNO = 0,15.24,79 = 3,7185 (L).
Câu 20:
1 mol khí ở điều kiện chuẩn tương đương 24,79 L
Phản ứng đốt cháy 1 mol hay 24,79L khí carbon monoxide (CO) tỏa ra nhiệt lượng là 283,0kJ.
⇒ Nếu đốt cháy hoàn toàn 2,479 L khí CO thì nhiệt lượng toả ra là:
\(\frac{{2,479.283,0}}{{24,79}} = 28,3\,\,kJ\)
Câu 22:
\(\begin{array}{l} {\Delta _r}H_{298}^o\, = [{\Delta _f}H_{298}^o(C{O_2}(g)) + {\Delta _f}H_{298}^o({H_2}O(l)).2{\rm{]}}\\ \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{\rm{ }} - {\rm{[}}{\Delta _f}H_{298}^o(C{H_4}(g)) + {\Delta _f}H_{298}^o({O_2}(g)).2]\\ \Rightarrow \;-{\rm{ }}890,3{\rm{ }} = {\rm{ }}\left[ {\left( {-{\rm{ }}393,5} \right){\rm{ }} + {\rm{ }}\left( {-{\rm{ }}285,8.2} \right)} \right]{\rm{ }}\\ {\rm{ }}-{\Delta _f}H_{298}^o\left( {C{H_4}\left( g \right)} \right) + {\rm{ }}0.2]\\ {\Delta _f}H_{298}^o\left( {C{H_4}\left( g \right)} \right) = {\rm{ }}-{\rm{ }}74,8{\rm{ }}kJ. \end{array}\)
Câu 23:
\(\begin{array}{l} {\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o({N_2}{O_4}){\rm{ }}-{\rm{ }}2.{\Delta _f}H_{298}^o(N{O_2})\\ {\Delta _r}H_{298}^o = {\rm{ }}9,16{\rm{ }}-{\rm{ }}2.33,18{\rm{ }} = {\rm{ }} - 57,2{\rm{ }}\left( {kJ} \right){\rm{ }} < {\rm{ }}0 \end{array}\)
Phản ứng tỏa nhiệt, N2O4 bền hơn NO2.
Câu 24:
\(\begin{array}{l} {\Delta _r}H_{298}^o = {\rm{ }}{E_{C = C\;}} + {\rm{ }}4.{E_{C - H\;}} + {\rm{ }}{E_{H - H\;}}-{\rm{ }}{E_{C - C\;}}-{\rm{ }}6{E_{C - H}}\\ = {\rm{ }}{E_{C = C\;}} + {\rm{ }}{E_{H - H\;}}-{\rm{ }}{E_{C - C\;}}-{\rm{ }}2{E_{C - H}}\\ = {\rm{ }}612{\rm{ }} + {\rm{ }}436{\rm{ }}-{\rm{ }}346{\rm{ }}-{\rm{ }}2.418{\rm{ }} = {\rm{ }} - 134{\rm{ }}\left( {kJ} \right) \end{array}\)
Câu 26:
\(CO\left( g \right) + C{l_2}\left( g \right)\mathop \to \limits^{than\,hoat\,tinh} COC{l_2}\left( g \right)\)
Áp dụng công thức:
\({\Delta _r}H_{298}^o = {E_b}(CO) + {E_b}(C{l_2}) - {E_b}(COC{l_2})\)
= EC≡O + ECl – Cl – EC=O – 2EC – Cl
→ Eb(C ≡ O) = 1075 kJ/ mol.
Phần II: Tự luận
Câu 1:
a) \(\mathop {\rm{S}}\limits^{{\rm{ + 4}}} {{\rm{O}}_{\rm{2}}}{\rm{\; + K}}\mathop {{\rm{Mn}}}\limits^{{\rm{ + 7}}} {{\rm{O}}_{\rm{4}}}{\rm{\; + }}{{\rm{H}}_{\rm{2}}}{\rm{O }} \to {\rm{ }}{{\rm{H}}_{\rm{2}}}\mathop {\rm{S}}\limits^{{\rm{ + 6}}} {{\rm{O}}_{\rm{4}}}{\rm{\; + }}{{\rm{K}}_{\rm{2}}}\mathop {\rm{S}}\limits^{{\rm{ + 6}}} {{\rm{O}}_{\rm{4}}}{\rm{\; + }}\mathop {{\rm{Mn}}}\limits^{{\rm{ + 2}}} {\rm{S}}{{\rm{O}}_{\rm{4}}}\)
Chất khử: SO2; chất oxi hoá: KMnO4.
Ta có các quá trình:
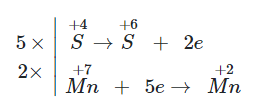
Phương trình hoá học:
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + K2SO4 + 2MnSO4
b) Theo phương trình hóa học ta có:
\({\rm{nS}}{{\rm{O}}_{\rm{2}}}{\rm{ = }}\frac{{\rm{5}}}{{\rm{2}}}{{\rm{n}}_{{\rm{KMn}}{{\rm{O}}_{\rm{4}}}}}{\rm{ = }}\frac{{\rm{5}}}{{\rm{2}}}{\rm{.0,02}}{\rm{.0,1 = 0,005(mol)}}\)
\({{\rm{V}}_{{\rm{S}}{{\rm{O}}_{\rm{2}}}}}{\rm{ = 24,79}}{\rm{.0,005 = 0,12395 L = 123,95 }}\left( {{\rm{mL}}} \right){\rm{.}}\)
Câu 2:
Xét phản ứng: H2O2(l) → H2O(l) + ½ O2 (g) (1)
Biến thiên enthalpy chuẩn của phản ứng:
\({{\Delta }_{r}}H{{_{298}^{o}}_{(1)}}=(-285,8)+\frac{1}{2}{{O}_{2}}-(-187,6)=-98,2(kJ).\)
Do \({\Delta _r}H_{298\left( 1 \right)}^o < 0\) nên phản ứng (1) diễn ra thuận lợi hay ở điều kiện chuẩn H2O2(l) kém bền, dễ dàng phân huỷ thành H2O(l) và O2(g).
- Xét phản ứng:
H2O(l) + ½ O2 (g) → H2O2(l) (2)
Biến thiên enthalpy chuẩn của phản ứng: \({{\Delta }_{r}}H{{_{298}^{o}}_{(2)}}=-{{\Delta }_{r}}H{{_{298}^{o}}_{(1)}}=98,2(kJ).\)
Do nên phản ứng (2) diễn ra không thuận lợi hay ở điều kiện chuẩn H2O(l) bền, khó bị phân huỷ.
Câu 3:
a) Phân tử NH3 có 3 liên kết N–H ⇒ 2 phân tử NH3 có 6 liên kết N–H.
Ta có: \({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{o}}=\text{ }{{E}_{N\equiv N}}~+~\mathbf{3}.{{E}_{HH~}}~\mathbf{6}.{{E}_{NH}}\)
\(\Rightarrow {{E}_{N~~H}}=9\frac{3+945+3\times 436}{6}=391(kJ/mol).\)
b) Enthalpy tạo thành chuẩn của NH3:
\({{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}\text{H}_{\text{298}}^{\text{o}}\text{=2}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}{{_{\text{298}}^{\text{o}}}_{(\text{N}{{\text{H}}_{\text{3}}}\text{)}}}\Rightarrow {{\text{ }\!\!\Delta\!\!\text{ }}_{\text{f}}}\text{H}{{_{\text{298}}^{\text{o}}}_{(\text{N}{{\text{H}}_{\text{3}}}\text{)}}}=\text{ }\text{ }46,5\text{ }kJ\text{ }mo{{l}^{-1}}.\)
--- Hết ---
Trên đây là toàn bộ nội dung Đề thi giữa học kì 2 môn Hoá 10 CTST năm 2022-2023 trường THPT Nguyễn Khuyến có đáp án . Để xem thêm nhiều tài liệu tham khảo hữu ích khác các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net.
Chúc các em học tập tốt và đạt thành tích cao trong học tập!