─Éß╗ā gi├║p c├Īc em hß╗Źc sinh lß╗øp 12 c├│ th├¬m t├Āi liß╗ću ├┤n tß║Łp, r├©n luyß╗ćn chuß║®n bß╗ŗ cho k├¼ thi sß║»p tß╗øi HOC247 giß╗øi thiß╗ću ─æß║┐n qu├Į thß║¦y c├┤ v├Ā c├Īc em hß╗Źc sinh t├Āi liß╗ću Bß╗Ö 5 ─æß╗ü thi giß╗»a HK2 m├┤n H├│a hß╗Źc 10 n─ām 2021 TrŲ░ß╗Øng THPT Giß╗ōng ├öng Tß╗æ dŲ░ß╗øi ─æ├óy ─æŲ░ß╗Żc bi├¬n tß║Łp v├Ā tß╗Ģng hß╗Żp vß╗øi phß║¦n ─æß╗ü v├Ā ─æ├Īp ├Īn, lß╗Øi giß║Żi chi tiß║┐t gi├║p c├Īc em tß╗▒ luyß╗ćn tß║Łp l├Ām ─æß╗ü. Hi vß╗Źng t├Āi liß╗ću n├Āy sß║Į c├│ ├Łch cho c├Īc em, ch├║c c├Īc em c├│ kß║┐t quß║Ż hß╗Źc tß║Łp tß╗æt!
|
TRŲ»ß╗£NG THPT GIß╗ÆNG ├öNG Tß╗É |
─Éß╗Ć THI GIß╗«A Hß╗īC K├ī 2 M├öN H├ōA Hß╗īC 10 THß╗£I GIAN 45 PH├ÜT |
─Éß╗Ć Sß╗É 1
I. PHß║”N TRß║«C NGHIß╗åM:(6,0 ─æiß╗ām )
C├óu 1: Hiß╗ćn tŲ░ß╗Żng quan s├Īt ─æŲ░ß╗Żc khi th├¬m dß║¦n nŲ░ß╗øc clo v├Āo dung dß╗ŗch KI c├│ chß╗®a sß║Ąn mß╗Öt ├Łt hß╗ō tinh bß╗Öt l├Ā
A. C├│ hŲĪi m├Āu t├Łm bay l├¬n B. Dung dß╗ŗch chuyß╗ān m├Āu v├Āng
C. Dung dß╗ŗch chuyß╗ān m├Āu xanh ─æß║Ęc trŲ░ng D. Kh├┤ng c├│ hiß╗ćn tŲ░ß╗Żng
C├óu 2: Dung dß╗ŗch AgNO3 kh├┤ng phß║Żn ß╗®ng vß╗øi dung dß╗ŗch n├Āo sau ─æ├óy?
A. NaCl. B. NaBr. C. NaI. D. NaF.
C├óu 3: Cho 7,8g hß╗Śn hß╗Żp Mg v├Ā MgCO3 t├Īc dß╗źng ho├Ān to├Ān vß╗øi dung dß╗ŗch HCl dŲ░ thu ─æŲ░ß╗Żc 4.48 lit hß╗æn hß╗Żp kh├Ł ß╗¤ ─æktc. Phß║¦n tr─ām khß╗æi lŲ░ß╗Żng Mg trong hß╗Śn hß╗Żp ban ─æß║¦u l├Ā:
A. 46.15 % B. 61.54 % C. 30.76 % D. 15.38 %
C├óu 4: Cho c├ón bß║▒ng (trong b├¼nh k├Łn) sau : CO2(k) + H2(k) Ōćö CO(k) + H2O(k) (DH > 0)
Yß║┐u tß╗æ n├Āo sau ─æ├óy kh├┤ng ß║Żnh hŲ░ß╗¤ng ─æß║┐n c├ón bß║▒ng cß╗¦a hß╗ć:
A. ├üp suß║źt B. Nß╗ōng ─æß╗Ö CO2. C. Nß╗ōng ─æß╗Ö H2O. D. Nhiß╗ćt ─æß╗Ö
C├óu 5: Phß║Żn ß╗®ng kh├┤ng xß║Ży ra l├Ā:
A. Sß╗źc kh├Ł CO2 v├Āo nŲ░ß╗øc Gia-ven.
B. Nh├║ng thanh nh├┤m v├Āo dung dß╗ŗch H2SO4 ─æß║Ęc, nguß╗Öi.
C. Sß╗źc kh├Ł SO2 v├Āo nŲ░ß╗øc brom.
D. Nh├║ng thanh sß║»t v├Āo dung dß╗ŗch HCl.
C├óu 6: Cho c├Īc yß║┐u tß╗æ sau: (a) Nß╗ōng ─æß╗Ö chß║źt; (b) ├üp suß║źt; (c) X├║c t├Īc; (d) Nhiß╗ćt ─æß╗Ö; (e) Diß╗ćn t├Łch tiß║┐p x├║c
Nhß╗»ng yß║┐u tß╗æ ß║Żnh hŲ░ß╗¤ng ─æß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng l├Ā:
A. a, c, e. B. a, b, c, d. C. b, c, d, e. D. a, b, c, d, e
C├óu 7: Chß╗ē ra ─æ├óu kh├┤ng phß║Żi l├Ā ─æß║Ęc ─æiß╗ām chung cß╗¦a tß║źt cß║Ż c├Īc halogen ?
A. Li├¬n kß║┐t trong ph├ón tß╗Ł halogen X2 l├Ā li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ kh├┤ng cß╗▒c
B. C├Īc nguy├¬n tß╗æ halogen ─æß╗üu c├│ khß║Ż n─āng thß╗ā hiß╗ćn c├Īc sß╗æ oxi ho├Ī ŌĆō1, +1, +3, +5, +7.
C. Halogen l├Ā nhß╗»ng phi kim ─æiß╗ān h├¼nh ─æß╗üu c├│ t├Łnh oxi h├│a mß║Īnh
D. Nguy├¬n tß╗Ł halogen dß╗ģ thu th├¬m 1 electron.
C├óu 8: C├Īc nguy├¬n tß╗æ nh├│m halogen c├│ cß║źu h├¼nh electron lß╗øp ngo├Āi c├╣ng l├Ā:
A. 3s2 3p5 B. ns2 np5 C. 2s2 2p5 D. 4s2 4p5
C├óu 9: Nhß║Łn ─æß╗ŗnh kh├┤ng ─æ├║ng l├Ā:
A. Kh├Ł SO2 l├Ā mß╗Öt oxit axit
B. Axit H2SO4 ─æß║Ęc l├Ā axit c├│ t├Łnh oxi h├│a mß║Īnh, t├Łnh h├Īo nŲ░ß╗øc
C. Kh├Ł H2S c├│ m├╣i trß╗®ng thß╗æi
D. Pha lo├Żng axit H2SO4─æß║Ęc bß║▒ng c├Īch r├│t tß╗½ tß╗½ nŲ░ß╗øc v├Āo axit.
C├óu 10: ─Éun n├│ng 5,6 gam bß╗Öt Fe v├Ā 1,6 gam bß╗Öt lŲ░u huß╗│nh trong b├¼nh k├Łn kh├┤ng c├│ kh├┤ng kh├Ł, sau phß║Żn ß╗®ng thu ─æŲ░ß╗Żc m gam chß║źt rß║»n X. Ng├óm X trong dung dß╗ŗch HCl dŲ░, thu ─æŲ░ß╗Żc hß╗Śn hß╗Żp kh├Ł Y. Phß║¦n tr─ām theo thß╗ā t├Łch cß╗¦a kh├Ł H2S trong Y l├Ā (c├Īc phß║Żn ß╗®ng xß║Ży ra ho├Ān to├Ān):
A. 50% B. 100% C. 75% D. 25%
C├óu 11: ß╗× ─æiß╗üu kiß╗ćn thŲ░ß╗Øng brom l├Ā chß║źt:
A. Rß║»n B. Kh├Ł. C. Lß╗Ång. D. Kh├┤ng x├Īc ─æß╗ŗnh
C├óu 12: Chß╗Źn ph├Īt biß╗āu sai:
A. C├│ thß╗ā d├╣ng Ag ─æß╗ā ph├ón biß╗ćt O2 v├Ā O3 . B. O3 l├Ā mß╗Öt dß║Īng th├╣ h├¼nh cß╗¦a oxi.
C. O2 tan tß╗æt trong nŲ░ß╗øc. D. T├Łnh oxi h├│a cß╗¦a O3 mß║Īnh hŲĪn O2.
C├óu 13: Cho h├¼nh vß║Į m├┤ tß║Ż th├Ł nghiß╗ćm ─æiß╗üu chß║┐ Cl2 tß╗½ MnO2 v├Ā dung dß╗ŗch HCl.
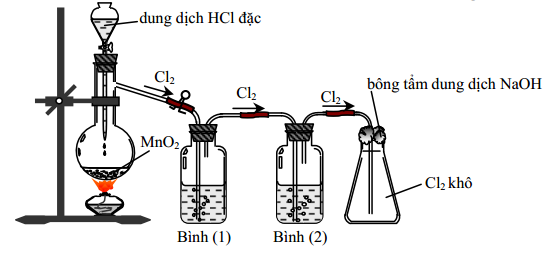
Kh├Ł Cl2 sinh ra thŲ░ß╗Øng c├│ lß║½n hŲĪi nŲ░ß╗øc v├Ā hidroclorua. ─Éß╗ā thu ─æŲ░ß╗Żc kh├Ł Cl2 kh├┤ th├¼ b├¼nh (1) v├Ā b├¼nh (2) lß║¦n lŲ░ß╗Żt ─æß╗▒ng
A. dung dß╗ŗch NaCl v├Ā dung dß╗ŗch H2SO4 ─æß║Ęc. B. dung dß╗ŗch NaOH v├Ā dung dß╗ŗch H2SO4 ─æß║Ęc.
C. dung dß╗ŗch H2SO4 ─æß║Ęc v├Ā dung dß╗ŗch AgNO3. D. dung dß╗ŗch H2SO4 ─æß║Ęc v├Ā dung dß╗ŗch NaCl.
C├óu 14: Thuß╗æc thß╗Ł d├╣ng ─æß╗ā ph├ón biß╗ćt 3 dung dß╗ŗch H2SO4, Ba(OH)2, HCl l├Ā:
A. Dung dß╗ŗch NaCl B. Dung dß╗ŗch NaOH C. Dung dß╗ŗch BaCl2 D. Dung dß╗ŗch Br2
C├óu 15: Cho phß║Żn ß╗®ng: aFe + bH2SO4─æß║Ęc ŌåÆ cFe2(SO4)3 + dSO2 + eH2O.
Tß╗ē lß╗ć sß╗æ nguy├¬n tß╗Ł bß╗ŗ khß╗Ł v├Ā sß╗æ nguy├¬n tß╗Ł bß╗ŗ oxi h├│a l├Ā:
A. 1:3 B. 3:2 C. 2:3 D. 3:1
C├óu 16: ─Éß╗ā trung h├▓a hß║┐t 200 gam dung dß╗ŗch HX (F, Cl, Br, I) nß╗ōng ─æß╗Ö 14,6% ngŲ░ß╗Øi ta phß║Żi d├╣ng 250 ml dung dß╗ŗch NaOH 3,2M. Dung dß╗ŗch axit ß╗¤ tr├¬n l├Ā:
A. HF B. HCl C. HBr D. HI
C├óu 17: Cho 4,48 l├Łt SO2 t├Īc dß╗źng vß╗øi 300ml dung dß╗ŗch NaOH 1M. Sau phß║Żn ß╗®ng thu ─æŲ░ß╗Żc m gam muß╗æi. Gi├Ī trß╗ŗ m?
A. 18,9g B. 20,8g C. 24,8g D. 23g
C├óu 18: Khi bß║»t ─æß║¦u phß║Żn ß╗®ng , nß╗ōng ─æß╗Ö mß╗Öt chß║źt l├Ā 0,024 mol/l . Sau 10 gi├óy xß║Ży ra phß║Żn ß╗®ng , nß╗ōng ─æß╗Ö cß╗¦a chß║źt ─æ├│ l├Ā 0,022 mol/l. Tß╗æc ─æß╗Ö phß║Żn ß╗®ng trong trŲ░ß╗Øng hß╗Żp n├Āy l├Ā :
A. 0,0003 mol/l.s. B. 0,00025 mol/l.s. C. 0,00015 mol/l.s. D. 0,0002 mol/l.s.
C├óu 19: Chß║źt d├╣ng l├Ām sß║Īch nŲ░ß╗øc v├Ā c├│ t├Īc dß╗źng bß║Żo vß╗ć c├Īc sinh vß║Łt tr├¬n tr├Īi ─æß║źt kh├┤ng bß╗ŗ bß╗®c xß║Ī tia cß╗▒c t├Łm l├Ā:
A. S. B. O3 C. O2 D. SO2
C├óu 20: Chß║źt vß╗½a c├│ t├Łnh khß╗Ł, vß╗½a c├│ t├Łnh oxi h├│a l├Ā:
A. H2SO4 ─æß║Ęc B. S C. H2S D. O2
II. PHß║”N Tß╗░ LUß║¼N:
C├óu 1: Cho 13,8 gam hß╗Śn hß╗Żp Al v├Ā Fe t├Īc dß╗źng vß╗øi dd H2SO4 lo├Żng dŲ░ thu ─æŲ░ß╗Żc 10,08 l├Łt kh├Ł (─æktc).
a) Viß║┐t phŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng xß║Ży ra.
b) T├Łnh % khß╗æi lŲ░ß╗Żng tß╗½ng kim loß║Īi trong hß╗Śn hß╗Żp
C├óu 2: Cho phß║Żn ß╗®ng sau : 2SO2(k) + O2 (k) Ōćö 2SO3 (k) , ŌłåH < 0
a) C├ón bß║▒ng cß╗¦a pß╗® tr├¬n sß║Į chuyß╗ān dß╗ŗch theo chiß╗üu n├Āo khi :
+ T─āng nß╗ōng ─æß╗Ö O2 + Giß║Żm ├Īp suß║źt cß╗¦a hß╗ć + Hß║Ī nhiß╗ćt ─æß╗Ö cß╗¦a hß╗ć
b) Giß║Żi th├Łch.
─É├üP ├üN ─Éß╗Ć Sß╗É 1
I. ĐÁP ÁN TRẮC NGHIỆM
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
C |
D |
A |
A |
B |
D |
B |
B |
D |
A |
C |
C |
A |
C |
B |
B |
D |
D |
B |
B |
II. ĐÁP ÁN TỰ LUẬN:
Câu 1
2Al + 3H2SO4 Al2(SO4)3 + 3H2
x 1,5x
Fe + H2SO4 FeSO4 + H2
y y
nH2 = 0,45 mol
Gß╗Źi x, y lß║¦n lŲ░ß╗Żt l├Ā sß╗æ mol Al, Fe
27x + 56y = 13,8 (1)
1,5x + y = 0,45
x= 0,2; y= 0,15
%m Al = 39,13% , %m Mg= 60,87%
C├óu 2: T─āng nß╗ōng ─æß╗Ö O2 c├ón bß║▒ng chuyß╗ān dß╗ŗch theo chiß╗üu thuß║Łn
Giß║Żm ├Īp suß║źt cß╗¦a hß╗ć c├ón bß║▒ng chuyß╗ān dß╗ŗch theo chiß╗üu nghß╗ŗch
Hß║Ī nhiß╗ćt ─æß╗Ö cß╗¦a hß╗ć c├ón bß║▒ng chuyß╗ān dß╗ŗch theo chiß╗üu thuß║Łn
T─āng nß╗ōng ─æß╗Ö O2 c├ón bß║▒ng chuyß╗ān dß╗ŗch theo chiß╗üu l├Ām cho nß╗ōng ─æß╗Ö O2 giß║Żm
Giß║Żm ├Īp suß║źt cß╗¦a hß╗ć c├ón bß║▒ng chuyß╗ān dß╗ŗch theo chiß╗üu t─āng ├Īp suß║źt (t─āng sß╗æ mol kh├Ł)
Hß║Ī nhiß╗ćt ─æß╗Ö cß╗¦a hß╗ć c├ón bß║▒ng chuyß╗ān dß╗ŗch theo chiß╗üu phß║Żn ß╗®ng tß╗Åa nhiß╗ćt
─Éß╗Ć Sß╗É 2
C├óu 1: H├Ży chß╗ē ra c├óu kh├┤ng ch├Łnh x├Īc.
A. B├Īn k├Łnh nguy├¬n tß╗Ł t─āng dß║¦n tß╗½ flo ─æß║┐n iot.
B. C├Īc hß╗Żp chß║źt cß╗¦a halogen vß╗øi hi─æro ─æß╗üu l├Ā chß║źt kh├Ł ß╗¤ ─æiß╗üu kiß╗ćn thŲ░ß╗Øng.
C. Tß╗½ flo ─æß║┐n iot, t├Łnh oxi h├│a cß╗¦a ch├║ng t─āng dß║¦n.
D. Trong tß║źt cß║Ż c├Īc hß╗Żp chß║źt, flo chß╗ē c├│ sß╗æ oxi ho├Ī l├Ā -1.
C├óu 2: Trong ph├▓ng th├Ł nghiß╗ćm, kh├Ł X ─æŲ░ß╗Żc ─æiß╗üu chß║┐ bß║▒ng c├Īch cho MnO2 t├Īc dß╗źng vß╗øi dung dß╗ŗch HCl ─æß║Ęc, ─æun n├│ng. X l├Ā
A. F2. B. O2. C. Cl2. D. H2.
C├óu 3: Sß╗źc 1,12 l├Łt kh├Ł SO2 (ß╗¤ ─æktc) v├Āo 200 ml dung dß╗ŗch NaOH 1M, sau phß║Żn ß╗®ng thu ─æŲ░ß╗Żc
A. 12,6 gam Na2SO3. B. 20,8 gam NaHSO3. C. 6,3 gam Na2SO3. D. 5,2 gam NaHSO3.
C├óu 4: H├▓a tan hß║┐t 30,4 gam hß╗Śn hß╗Żp X gß╗ōm Cu, CuS, Cu2S, S bß║▒ng HNO3 dŲ░ thu ─æŲ░ß╗Żc 20,16 l├Łt kh├Ł NO duy nhß║źt (─æktc). Th├¬m Ba(OH)2 dŲ░ v├Āo dung dß╗ŗch sau phß║Żn ß╗®ng thu ─æŲ░ß╗Żc m gam kß║┐t tß╗¦a. Gi├Ī trß╗ŗ cß╗¦a m l├Ā
A. 110,95 gam. B. 104,02 gam. C. 115,85 gam. D. 81,55 gam.
C├óu 5: Dung dß╗ŗch dŲ░ß╗øi ─æ├óy kh├┤ng phß║Żn ß╗®ng vß╗øi dung dß╗ŗch AgNO3 l├Ā
A. KI. B. NaF. C. HBr. D. NaCl.
C├óu 6: Cho 1,67 gam hß╗Śn hß╗Żp gß╗ōm hai kim loß║Īi ß╗¤ 2 chu kß╗│ li├¬n tiß║┐p thuß╗Öc nh├│m IIA t├Īc dß╗źng hß║┐t vß╗øi dung dß╗ŗch H2SO4 (dŲ░), tho├Īt ra 0,672 l├Łt kh├Ł H2 (ß╗¤ ─æktc). Hai kim loß║Īi ─æ├│ l├Ā
A. Sr v├Ā Ba. B. Ca v├Ā Sr. C. Mg v├Ā Ca. D. Be v├Ā Mg.
C├óu 7: C├│ 3 dung dß╗ŗch kh├┤ng m├Āu ─æß╗▒ng trong 3 lß╗Ź ho├Ī chß║źt mß║źt nh├Żn: NaCl, K2CO3, BaCl2. ─Éß╗ā ph├ón biß╗ćt 3 dung dß╗ŗch tr├¬n, d├╣ng thuß╗æc thß╗Ł l├Ā
A. NaOH. B. H2SO4. C. HCl. D. BaCl2.
C├óu 8: Thuß╗æc thß╗Ł ─æß╗ā ph├ón biß╗ćt CO2 v├Ā SO2 l├Ā
A. dung dß╗ŗch Br2. B. dung dß╗ŗch NaHSO3.
C. dung dß╗ŗch Ba(OH)2. D. dung dß╗ŗch Ca(OH)2.
C├óu 9: Phß║Żn ß╗®ng d├╣ng ─æß╗ā ─æiß╗üu chß║┐ oxi trong c├┤ng nghiß╗ćp l├Ā
A. 2KMnO4 ŌåÆ K2MnO4 + MnO2 + O2
B. KNO3 ŌåÆ KNO2 + 1/2O2
C. 2Ag + O3 ŌåÆ Ag2O + O2
D. 2H2O ŌåÆ 2H2 + O2
C├óu 10: Dung dß╗ŗch ─æŲ░ß╗Żc d├╣ng ─æß╗ā khß║»c h├¼nh l├¬n nhß╗»ng ─æß╗ō d├╣ng bß║▒ng thuß╗Ę tinh l├Ā
A. H2SO4 ─æß║Ęc. B. H2SO4 lo├Żng. C. HCl. D. HF.
---(Nß╗Öi dung ─æß║¦y ─æß╗¦, chi tiß║┐t tß╗½ c├óu 11 ─æß║┐n c├óu 30 cß╗¦a ─æß╗ü thi sß╗æ 2 vui l├▓ng xem tß║Īi online hoß║Ęc ─æ─āng nhß║Łp ─æß╗ā tß║Żi vß╗ü m├Īy)---
─É├üP ├üN ─Éß╗Ć Sß╗É 2
|
1 |
C |
11 |
C |
21 |
A |
|
2 |
C |
12 |
B |
22 |
D |
|
3 |
C |
13 |
C |
23 |
D |
|
4 |
A |
14 |
C |
24 |
C |
|
5 |
B |
15 |
B |
25 |
A |
|
6 |
B |
16 |
D |
26 |
A |
|
7 |
B |
17 |
B |
27 |
A |
|
8 |
A |
18 |
D |
28 |
D |
|
9 |
D |
19 |
D |
29 |
A |
|
10 |
D |
20 |
D |
30 |
B |
─Éß╗Ć Sß╗É 3
I. PHß║”N TRß║«C NGHIß╗åM:
C├óu 1: Phß║Żn ß╗®ng kh├┤ng xß║Ży ra l├Ā:
A. Nh├║ng thanh nh├┤m v├Āo dung dß╗ŗch H2SO4 ─æß║Ęc, nguß╗Öi.
B. Sß╗źc kh├Ł CO2 v├Āo nŲ░ß╗øc Gia-ven.
C. Sß╗źc kh├Ł SO2 v├Āo nŲ░ß╗øc brom.
D. Nh├║ng thanh sß║»t v├Āo dung dß╗ŗch HCl.
C├óu 2: Cho c├Īc yß║┐u tß╗æ sau: (a) Nß╗ōng ─æß╗Ö chß║źt; (b) ├üp suß║źt; (c) X├║c t├Īc; (d) Nhiß╗ćt ─æß╗Ö; (e) Diß╗ćn t├Łch tiß║┐p x├║c
Nhß╗»ng yß║┐u tß╗æ ß║Żnh hŲ░ß╗¤ng ─æß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng l├Ā:
A. a, c, e. B. b, c, d, e. C. a, b, c, d, e D. a, b, c, d.
C├óu 3: ─Éß╗ā trung h├▓a hß║┐t 200 gam dung dß╗ŗch HX (F, Cl, Br, I) nß╗ōng ─æß╗Ö 14,6% ngŲ░ß╗Øi ta phß║Żi d├╣ng 250 ml dung dß╗ŗch NaOH 3,2M. Dung dß╗ŗch axit ß╗¤ tr├¬n l├Ā:
A. HI B. HCl C. HF D. HBr
C├óu 4: Khi bß║»t ─æß║¦u phß║Żn ß╗®ng , nß╗ōng ─æß╗Ö mß╗Öt chß║źt l├Ā 0,024 mol/l . Sau 10 gi├óy xß║Ży ra phß║Żn ß╗®ng , nß╗ōng ─æß╗Ö cß╗¦a chß║źt ─æ├│ l├Ā 0,022 mol/l. Tß╗æc ─æß╗Ö phß║Żn ß╗®ng trong trŲ░ß╗Øng hß╗Żp n├Āy l├Ā :
A. 0,00025 mol/l.s. B. 0,0003 mol/l.s. C. 0,0002 mol/l.s. D. 0,00015 mol/l.s.
C├óu 5: ─Éun n├│ng 5,6 gam bß╗Öt Fe v├Ā 1,6 gam bß╗Öt lŲ░u huß╗│nh trong b├¼nh k├Łn kh├┤ng c├│ kh├┤ng kh├Ł, sau phß║Żn ß╗®ng thu ─æŲ░ß╗Żc m gam chß║źt rß║»n X. Ng├óm X trong dung dß╗ŗch HCl dŲ░, thu ─æŲ░ß╗Żc hß╗Śn hß╗Żp kh├Ł Y. Phß║¦n tr─ām theo thß╗ā t├Łch cß╗¦a kh├Ł H2S trong Y l├Ā (c├Īc phß║Żn ß╗®ng xß║Ży ra ho├Ān to├Ān):
A. 50% B. 75% C. 25% D. 100%
C├óu 6: Cho 7,8g hß╗Śn hß╗Żp Mg v├Ā MgCO3 t├Īc dß╗źng ho├Ān to├Ān vß╗øi dung dß╗ŗch HCl dŲ░ thu ─æŲ░ß╗Żc 4.48 lit hß╗æn hß╗Żp kh├Ł ß╗¤ ─æktc. Phß║¦n tr─ām khß╗æi lŲ░ß╗Żng Mg trong hß╗Śn hß╗Żp ban ─æß║¦u l├Ā:
A. 61.54 % B. 46.15 % C. 15.38 % D. 30.76 %
C├óu 7: Hiß╗ćn tŲ░ß╗Żng quan s├Īt ─æŲ░ß╗Żc khi th├¬m dß║¦n nŲ░ß╗øc clo v├Āo dung dß╗ŗch KI c├│ chß╗®a sß║Ąn mß╗Öt ├Łt hß╗ō tinh bß╗Öt l├Ā
A. Dung dß╗ŗch chuyß╗ān m├Āu xanh ─æß║Ęc trŲ░ng B. Kh├┤ng c├│ hiß╗ćn tŲ░ß╗Żng
C. Dung dß╗ŗch chuyß╗ān m├Āu v├Āng D. C├│ hŲĪi m├Āu t├Łm bay l├¬n
C├óu 8: Cho phß║Żn ß╗®ng: aFe + bH2SO4─æß║Ęc ŌåÆ cFe2(SO4)3 + dSO2 + eH2O.
Tß╗ē lß╗ć sß╗æ nguy├¬n tß╗Ł bß╗ŗ khß╗Ł v├Ā sß╗æ nguy├¬n tß╗Ł bß╗ŗ oxi h├│a l├Ā:
A. 3:2 B. 3:1 C. 2:3 D. 1:3
C├óu 9: Thuß╗æc thß╗Ł d├╣ng ─æß╗ā ph├ón biß╗ćt 3 dung dß╗ŗch H2SO4, Ba(OH)2, HCl l├Ā:
A. Dung dß╗ŗch NaCl B. Dung dß╗ŗch NaOH C. Dung dß╗ŗch BaCl2 D. Dung dß╗ŗch Br2
C├óu 10: ß╗× ─æiß╗üu kiß╗ćn thŲ░ß╗Øng brom l├Ā chß║źt:
A. Rß║»n B. Kh├Ł. C. Lß╗Ång. D. Kh├┤ng x├Īc ─æß╗ŗnh
---(Nß╗Öi dung ─æß║¦y ─æß╗¦, chi tiß║┐t tß╗½ c├óu 11 ─æß║┐n c├óu 22 cß╗¦a ─æß╗ü thi sß╗æ 3 vui l├▓ng xem tß║Īi online hoß║Ęc ─æ─āng nhß║Łp ─æß╗ā tß║Żi vß╗ü m├Īy)---
─É├üP ├üN ─Éß╗Ć Sß╗É 3
I. TRẮC NGHIỆM
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
A |
C |
B |
C |
A |
B |
A |
A |
C |
C |
D |
D |
D |
D |
C |
D |
B |
B |
D |
B |
─Éß╗Ć Sß╗É 4
C├óu 41: ─Éß╗ā h├▓a tan hß║┐t mß╗Öt lŲ░ß╗Żng Al(OH)3 cß║¦n vß╗½a ─æß╗¦ 300 gam dung dß╗ŗch HCl 7,3%. C┼®ng h├▓a tan hß║┐t lŲ░ß╗Żng Al(OH)3 ─æ├│, cß║¦n vß╗½a ─æß╗¦ V l├Łt dung dß╗ŗch NaOH 0,5M. Gi├Ī trß╗ŗ cß╗¦a V l├Ā
A. 0,1. B. 0,3. C. 0,2. D. 0,4.
C├óu 42: Tß╗Ģng c├Īc electron thuß╗Öc c├Īc ph├ón lß╗øp p cß╗¦a nguy├¬n tß╗Ł nguy├¬n tß╗æ X l├Ā 11. Vß║Ły sß╗æ hiß╗ću nguy├¬n tß╗Ł cß╗¦a X l├Ā:
A. 11 B. 17 C. 15 D. 16
C├óu 43: Cho m gam Ba v├Āo 250 ml dung dß╗ŗch HCl aM, thu ─æŲ░ß╗Żc dung dß╗ŗch X v├Ā 6,72 l├Łt kh├Ł H2 (─æktc). C├┤ cß║Īn dung dß╗ŗch X thu ─æŲ░ß╗Żc 55 gam chß║źt rß║»n khan. Gi├Ī trß╗ŗ cß╗¦a a l├Ā
A. 0,4. B. 2,0. C. 0,8. D. 2,4.
C├óu 44: Tß╗Ģng sß╗æ hß║Īt mang ─æiß╗ćn trong ion Al3+ l├Ā
A. 12. B. 24. C. 23. D. 26.
C├óu 45: Dß║½n 3,36 l├Łt kh├Ł CO2 (─æktc) v├Āo dung dß╗ŗch NaOH 1M. Thß╗ā t├Łch dung dß╗ŗch NaOH tß╗æi thiß╗āu cß║¦n d├╣ng ─æß╗ā phß║Żn ß╗®ng hß║┐t vß╗øi lŲ░ß╗Żng CO2 n├│i tr├¬n l├Ā
A. 100 ml. B. 300 ml. C. 200 ml. D. 150ml.
C├óu 46: Trong 1 chu k├¼, ─æi tß╗½ tr├Īi sang phß║Żi, theo chiß╗üu Z t─āng dß║¦n, b├Īn k├Łnh nguy├¬n tß╗Ł
A. t─āng dß║¦n. B. giß║Żm dß║¦n. C. kh├┤ng ─æß╗Ģi. D. kh├┤ng x├Īc ─æß╗ŗnh.
C├óu 47: H├▓a tan 8,4g mß╗Öt hß╗Śn hß╗Żp 2 kim loß║Īi thuß╗Öc nh├│m IIA v├Ā thuß╗Öc 2 chu k├¼ li├¬n tiß║┐p trong dung dß╗ŗch HCl, thu 6,72 l├Łt H2 (─æktc). Hai kim loß║Īi l├Ā
A. Be v├Ā Mg. B. Ca v├Ā Be. C. Mg v├Ā Ca. D. Ca v├Ā Ba.
C├óu 48: Lß╗øp electron thß╗® n c├│ tß╗æi ─æa 18 electron. Gi├Ī trß╗ŗ n bß║▒ng
A. n = 1 B. n = 4 C. n = 2 D. n = 3
C├óu 49: 500 ml dung dß╗ŗch NaOH 1,0 M c├│ sß╗æ mol tŲ░ŲĪng ß╗®ng l├Ā
A. 1,2 mol. B. 6,0 mol. C. 0,5 mol. D. 0,6 mol.
C├óu 50: ─Éiß╗üu khß║│ng ─æß╗ŗnh n├Āo sau ─æ├óy l├Ā sai ?
A. Hß║Īt nh├ón nguy├¬n tß╗Ł ─æŲ░ß╗Żc cß║źu tß║Īo n├¬n bß╗¤i c├Īc hß║Īt proton, electron, nŲĪtron.
B. Trong nguy├¬n tß╗Ł sß╗æ hß║Īt proton bß║▒ng sß╗æ hß║Īt electron.
C. Sß╗æ khß╗æi A l├Ā tß╗Ģng sß╗æ proton (Z) v├Ā tß╗Ģng sß╗æ nŲĪtron (N).
D. Nguy├¬n tß╗Ł ─æŲ░ß╗Żc cß║źu tß║Īo n├¬n bß╗¤i c├Īc hß║Īt proton, electron, nŲĪtron.
---(Nß╗Öi dung ─æß║¦y ─æß╗¦, chi tiß║┐t tß╗½ c├óu 51 ─æß║┐n c├óu 80 cß╗¦a ─æß╗ü thi sß╗æ 4 vui l├▓ng xem tß║Īi online hoß║Ęc ─æ─āng nhß║Łp ─æß╗ā tß║Żi vß╗ü m├Īy)---
─É├üP ├üN ─Éß╗Ć Sß╗É 4
|
1 |
D |
11 |
D |
21 |
C |
31 |
D |
|
2 |
B |
12 |
D |
22 |
A |
32 |
B |
|
3 |
C |
13 |
D |
23 |
B |
33 |
A |
|
4 |
C |
14 |
B |
24 |
B |
34 |
C |
|
5 |
D |
15 |
A |
25 |
A |
35 |
B |
|
6 |
B |
16 |
A |
26 |
A |
36 |
A |
|
7 |
C |
17 |
D |
27 |
A |
37 |
B |
|
8 |
D |
18 |
C |
28 |
D |
38 |
C |
|
9 |
C |
19 |
C |
29 |
B |
39 |
C |
|
10 |
A |
20 |
B |
30 |
D |
40 |
A |
─Éß╗Ć Sß╗É 5
Câu 1:
a) H├Ży cho biß║┐t gi├Ī trß╗ŗ cß╗¦a 1u bß║▒ng bao nhi├¬u kg?
b) Nguy├¬n tß╗Ł Mg c├│ khß╗æi lŲ░ß╗Żng l├Ā 24,31u. H├Ży t├Łnh khß╗æi lŲ░ß╗Żng cß╗¦a Mg theo ─æŲĪn vß╗ŗ kg?
C├óu 2: H├Ży cho biß║┐t sß╗æ ─æŲĪn vß╗ŗ ─æiß╗ćn t├Łch hß║Īt nh├ón, sß╗æ proton, sß╗æ nŲĪtron, sß╗æ electron v├Ā sß╗æ khß╗æi cß╗¦a nhß╗»ng nguy├¬n tß╗Ł c├│ k├Ł hiß╗ću sau ─æ├óy:
3919K ; 5626Fe ; 23490Th ; 3115P
Câu 3:
a) Viß║┐t c├┤ng thß╗®c cß╗¦a c├Īc loß║Īi ph├ón tß╗Ł ─æß╗ōng (II) oxit, biß║┐t rß║▒ng ─æß╗ōng v├Ā oxi c├│ c├Īc ─æß╗ōng vß╗ŗ sau:
6329Cu ; 6529Cu ; 168O ; 178O ; 188O .
b) T├Łnh ph├ón tß╗Ł khß╗æi cß╗¦a c├Īc ph├ón tß╗Ł n├│i tr├¬n.
C├óu 4: Cho nguy├¬n tß╗æ X c├│ tß╗Ģng sß╗æ hß║Īt trong nguy├¬n tß╗Ł l├Ā 46, trong ─æ├│ sß╗æ hß║Īt mang ─æiß╗ćn nhiß╗üu hŲĪn sß╗æ hß║Īt kh├┤ng mang ─æiß╗ćn l├Ā 14 hß║Īt. H├Ży x├Īc ─æß╗ŗnh sß╗æ proton, sß╗æ nŲĪtron, sß╗æ electron, sß╗æ khß╗æi v├Ā viß║┐t k├Ł hiß╗ću nguy├¬n tß╗Ł cß╗¦a nguy├¬n tß╗æ X.
Câu 5.a:
a) Viß║┐t cß║źu h├¼nh electron nguy├¬n tß╗Ł cß╗¦a c├Īc nguy├¬n tß╗æ c├│ A (Z=17) v├Ā B (Z=26).
Nguy├¬n tß╗æ A,B l├Ā kim loß║Īi, phi kim, kh├Ł hiß║┐m, v├¼ sao?
b) Trong tß╗▒ nhi├¬n Argon c├│ 3 loß║Īi ─æß╗ōng vß╗ŗ bß╗ün vß╗øi tß╗ē lß╗ć % nguy├¬n tß╗Ł l├Ā:
3618Ar (0,337%) ; 3818Ar (0,063%) ; 4018Ar (99,6%)
Cho rß║▒ng nguy├¬n tß╗Ł khß╗æi cß╗¦a c├Īc ─æß╗ōng vß╗ŗ tr├╣ng vß╗øi sß╗æ khß╗æi cß╗¦a ch├║ng.
- T├Łnh nguy├¬n tß╗Ł khß╗æi trung b├¼nh cß╗¦a Argon.
- T├Łnh thß╗ā t├Łch cß╗¦a 20gam Argon (ß╗¤ ─æktc)
Câu 5.b:
a) Viß║┐t cß║źu h├¼nh electron nguy├¬n tß╗Ł cß╗¦a c├Īc nguy├¬n tß╗æ c├│ Z = 9, Z = 18, Z = 35
b) Nguy├¬n tß╗æ Kali trong tß╗▒ nhi├¬n c├│ c├Īc ─æß╗ōng vß╗ŗ: 39K, 40K, 41K vß╗øi tß╗ē lß╗ć % sß╗æ nguy├¬n tß╗Ł tŲ░ŲĪng ß╗®ng lß║¦n lŲ░ß╗Żt l├Ā: 93,08%; 6,12%.
- T├Łnh tß╗ē lß╗ć % cß╗¦a ─æß╗ōng vß╗ŗ 41K?
- T├Łnh nguy├¬n tß╗Ł khß╗æi trung b├¼nh cß╗¦a nguy├¬n tß╗æ K?
---(Nß╗Öi dung ─æß║¦y ─æß╗¦, chi tiß║┐t ─æ├Īp ├Īn cß╗¦a ─æß╗ü thi sß╗æ 5 vui l├▓ng xem tß║Īi online hoß║Ęc ─æ─āng nhß║Łp ─æß╗ā tß║Żi vß╗ü m├Īy)---
Tr├¬n ─æ├óy l├Ā mß╗Öt phß║¦n tr├Łch dß║½n nß╗Öi dung Bß╗Ö 5 ─æß╗ü thi giß╗»a HK2 m├┤n H├│a hß╗Źc 10 n─ām 2021 c├│ ─æ├Īp ├Īn TrŲ░ß╗Øng THPT Giß╗ōng ├öng Tß╗æ. ─Éß╗ā xem to├Ān bß╗Ö nß╗Öi dung c├Īc em ─æ─āng nhß║Łp v├Āo trang hoc247.net ─æß╗ā tß║Żi t├Āi liß╗ću vß╗ü m├Īy t├Łnh.
Hy vß╗Źng t├Āi liß╗ću n├Āy sß║Į gi├║p c├Īc em hß╗Źc sinh ├┤n tß║Łp tß╗æt v├Ā ─æß║Īt th├Ānh t├Łch cao trong hß╗Źc tß║Łp.
Ngo├Āi ra c├Īc em c├│ thß╗ā tham khß║Żo th├¬m mß╗Öt sß╗æ tŲ░ liß╗ću c├╣ng chuy├¬n mß╗źc tß║Īi ─æ├óy:
- Bß╗Ö 5 ─æß╗ü thi giß╗»a HK2 m├┤n H├│a hß╗Źc 10 n─ām 2021 c├│ ─æ├Īp ├Īn TrŲ░ß╗Øng THPT Nguyß╗ģn Trung Trß╗▒c
- Bß╗Ö 5 ─æß╗ü thi giß╗»a HK2 m├┤n H├│a hß╗Źc 10 n─ām 2021 c├│ ─æ├Īp ├Īn TrŲ░ß╗Øng THPT Phan Chu Trinh
Ch├║c c├Īc em hß╗Źc tß╗æt!
TŲ░ liß╗ću nß╗Ģi bß║Łt tuß║¦n
- Xem thêm







