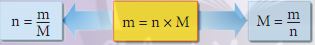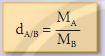Các hạt (nguyên tử, phân tử) có kích thước và khối lượng vô cùng nhỏ bé, không thể xác định được bằng các dụng cụ đo thường dùng. Làm thế nào để có thể xác định một cách dễ dàng số nguyên tử, phân tử và khối lượng, thể tích (đối với chất khí) của các chất? Chúng ta hãy cùng tìm hiểu qua bài học dưới đây Bài 5: Mol và tỉ khối của chất khí trong chương trình Khoa học tự nhiên 8 Chân trời sáng tạo.
Tóm tắt lý thuyết
1.1. Mol
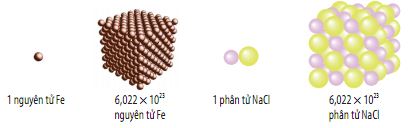
Hình 5.1. Minh họa 1 nguyên tử (phân tử) và 1 mol nguyên tử (phân tử)
Mol là lượng chất có chứa 6,022 × 1023 nguyên tử hay phân tử của chất đó.
Số 6,022 × 1023 gọi là số Avogadro và được kí hiệu là N.
1.2. Khối lượng mol
a. Tìm hiểu khái niệm khối lượng mol
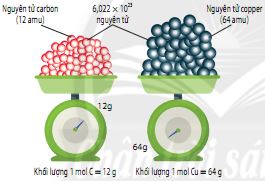
Hình 5.2. Minh họa khối lượng của 1 mol các chất
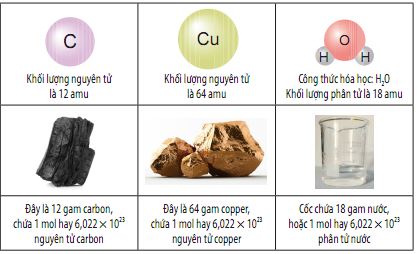
Bảng. Khối lượng mol của một số chất
Khối lượng mol (kí hiệu là M) của một chất là khối lượng tính bằng gam của 1 mol chất đó. Đơn vị khối lượng mol là gam/mol (hay gam.mol-1).
b. Chuyển đổi giữa số mol và khối lượng
1.3. Thể tích mol chất khí
a. Khái niệm
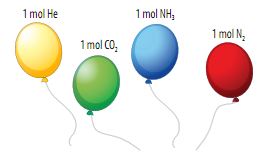
Một mol bất kì khí nào, trong cùng điều kiện nhiệt độ và áp suất đều chiếm những thể tích bằng nhau, người ta gọi đó là thể tích mol chất khí.
Hình 5.3. Minh họa thể tích mol các chất khí
Định luật Avogadro: Trong cùng điều kiện nhiệt độ và áp suất, các khí có cùng thể tích sẽ chứa cùng số mol.
Ở điều kiện chuẩn (đkc) áp suất 1 bar, nhiệt độ 25oC thì 1 mol bất kì khí nào cũng đều chiếm thể tích 24,79 lít.
Ví dụ: Thể tích 1 mol khí O2 cũng như 1 mol khí N2 ở điều kiện chuẩn đều là 24,79 lít.
b. Chuyển đổi giữa số mol và thể tích
Gọi n là số mol chất khí (mol), V là thể tích của chất khí ở đkc (lít), ta có công thức chuyển đổi sau:
1.4. Tỉ khối của chất khí
- Tỉ khối của chất khí A đối với khí B là tỉ số giữa khối lượng mol của khí A và khối lượng mol của khí B.
- Trong đó:
+ dA/B là tỉ khối của khí A đối với khí B.
+ MA, MB là khối lượng mol của khí A và khí B (gam/mol).
Bài tập minh họa
Ví dụ 1: Tính số mol nguyên tử Na có trong 1,5.1023 nguyên tử Na.
Hướng dẫn giải
Số mol nguyên tử Na có trong 1,5.1023 nguyên tử Na là:
\(n = \frac{A}{N} = \frac{{1,{{5.10}^{23}}}}{{{{6.10}^{23}}}} = 0,25(mol)\)
Ví dụ 2: Cho 2,24 lít khí B (đktc). Hãy tính số mol của khí B.
Hướng dẫn giải
Ta có: VB = 2,24 lít
Số mol của khí B là: \(n = \frac{V}{{22,4}} = 0,1(mol)\).
Vậy số mol của khí B là 0,1 mol.
Luyện tập Bài 5 Khoa học tự nhiên 8 Chân trời sáng tạo
Học xong bài này các em cần biết:
– Nêu được khái niệm về mol (nguyên tử, phân tử).
– Tính được khối lượng mol (M); chuyển đổi được giữa số mol (n) và khối lượng (m).
– Nêu được khái niệm thể tích mol của chất khí ở áp suất 1 bar và 25 °C.
– Sử dụng được công thức để chuyển đổi giữa số mol và thể tích chất khí ở điều kiện chuẩn: áp suất 1 bar ở 25 °C.
– Nêu được khái niệm tỉ khối, viết được công thức tính tỉ khối của chất khí.
– So sánh được chất khí này nặng hay nhẹ hơn chất khí khác dựa vào công thức tính tỉ khối.
3.1. Trắc nghiệm Bài 5 Khoa học tự nhiên 8 Chân trời sáng tạo
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm KHTN 8 Chân trời sáng tạo Bài 5 cực hay có đáp án và lời giải chi tiết.
-
- A. 1 : 1.
- B. 1 : 2.
- C. 2 : 1
- D. 1 : 3.
-
- A. 0,5 mol.
- B. 1,0 mol.
- C. 2,0 mol.
- D. 2,5 mol.
-
- A. \(H=\frac{{{m}_{LT}}}{{{m}_{TT}}}.100%\)
- B. \(H=\frac{{{m}_{TT}}}{{{m}_{LT}}}.100%\)
- C. \(H=\frac{{{m}_{LT}}}{{{n}_{TT}}}.100%\)
- D. \(H={{m}_{LT}}.{{m}_{TT}}.100%\)
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 5 Khoa học tự nhiên 8 Chân trời sáng tạo
Các em có thể xem thêm phần hướng dẫn Giải bài tập KHTN 8 Chân trời sáng tạo Bài 5 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Khởi động trang 27 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Giải Câu hỏi 1 trang 27 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Vận dụng trang 28 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Giải Câu hỏi 2 trang 28 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Giải Câu hỏi 3 trang 28 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Giải Câu hỏi 4 trang 28 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Luyện tập trang 29 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Luyện tập trang 29 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Giải Câu hỏi 5 trang 29 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Giải Câu hỏi 6 trang 30 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Giải Câu hỏi 7 trang 30 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Luyện tập trang 30 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Vận dụng trang 30 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Giải Câu hỏi 8 trang 30 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Luyện tập 1 trang 31 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Luyện tập 2 trang 31 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Vận dụng trang 31 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Hỏi đáp Bài 5 Khoa học tự nhiên 8 Chân trời sáng tạo
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Khoa học tự nhiên HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!