Trong cuộc sống, chúng ta thường gặp những biến đổi hoá học như trái cây xanh (vị chát) chuyển thành trái cây chín (vị ngọt), đốt gas để nấu chín thực phẩm, thức ăn để lâu bị ôi thiu, ... Những biến đổi này đều xảy ra phản ứng hoá học. Phản ứng hoá học là gì? Dấu hiệu nào chứng tỏ có phản ứng hoá học xảy ra? Chúng ta hãy cùng tìm hiểu qua bài học dưới đây Bài 3: Phản ứng hóa học và năng lượng trong các phản ứng hóa học trong chương trình Khoa học tự nhiên 8 Chân trời sáng tạo. Mời các em cùng tham khảo!
Tóm tắt lý thuyết
1.1. Phản ứng hoá học
- Quá trình biến đổi chất này thành chất khác được gọi là phản ứng hoá học.
- Chất tham gia phản ứng gọi là chất đầu.
- Chất mới tạo thành gọi là sản phẩm.
Ví dụ: Hỗn hợp sắt (iron) và lưu huỳnh (sulfur) đã phản ứng với nhau khi đun nóng để tạo thành hợp chất iron(II) sulfide (FeS).
Hình 3.1. a) Hỗn hợp bột sắt với lưu huỳnh trước khi đun; b) Chất rắn sau khi đun
Trong đó chất đầu là sắt và lưu huỳnh; sản phẩm là iron(II) sulfide.
1.2. Diễn biến của phản ứng hoá học
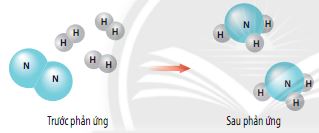
Trong phản ứng hoá học, có sự phá vỡ liên kết cũ và hình thành liên kết mới. Kết quả là chất này biến đổi thành chất khác.
Hình 3.2. Sơ đồ minh họa phản ứng hóa học giữa hydrogen và nitrogen tạo thành ammonia
1.3. Một số dấu hiệu nhận biết có phản ứng hoá học xảy ra
Một số dấu hiệu có thể nhận biết phản ứng hoá học xảy ra: xuất hiện chất khí, chất kết tủa; thay đổi màu sắc, mùi; phát sáng, giải phóng hoặc hấp thụ nhiệt năng, …
Hình 3.3. a) Gas cháy sẽ toả nhiệt; b) Phản ứng phân huỷ đường thành than và hơi nước; c) Chất kết tủa tạo thành sau phản ứng
1.4. Năng lượng trong phản ứng hoá học
a. Phản ứng toả nhiệt, phản ứng thu nhiệt
Trong một phản ứng hoá học, luôn có sự thay đổi năng lượng. Năng lượng có thể toả ra hoặc nhận vào, thường dưới dạng nhiệt. Vì vậy, ta có thể chia phản ứng thành hai nhóm: phản ứng toả nhiệt và phản ứng thu nhiệt.
+ Phản ứng toả nhiệt là phản ứng có sự giải phóng năng lượng ra môi trường bên ngoài, thể hiện ở sự gia tăng nhiệt độ.
Những phản ứng toả nhiệt có thể được viết tổng quát như sau:
| Chất phản ứng → Sản phẩm + năng lượng |
+ Phản ứng thu nhiệt là những phản ứng hấp thụ năng lượng từ môi trường xung quanh.
Những phản ứng thu nhiệt có thể được viết tổng quát như sau:
| Chất phản ứng + năng lượng → Sản phẩm |
b. Các ứng dụng phổ biến của phản ứng toả nhiệt
Sự đốt cháy nhiên liệu (than, dầu hoả, gas, …) tạo ra năng lượng nhiệt phục vụ cho việc nấu nướng, sưởi ấm, …
Quá trình hô hấp trong cơ thể cung cấp năng lượng để cơ thể hoạt động, đồng thời tạo nên thân nhiệt ổn định và hỗ trợ quá trình vận động.
Bài tập minh họa
Bài tập 1: Phản ứng hóa học là gì? Nêu ví dụ
Hướng dẫn giải
Phản ứng hóa học là quá trình biến đổi chất này thành chất khác.
Ví dụ: Thả một mảnh sắt (Fe) vào dung dịch axit clohidric (HCl) thấy sinh ra khí Hidro (H2)
Bài tập 2: Trong các trường hợp sau, trường hợp không là phương trình hóa học
A. Rượu để trong chai không kín bị cạn dần
B. Sắt cho tác dụng với oxi tạo ra khí SO2
C. Natri cháy trong không khí thành Na2O
D. Tất cả đáp án
Hướng dẫn giải
Trong chai đựng rượu đồng thời xảy ra hai quá trình bay hơi và ngưng tụ, là vì chai được đậy kín, nên có bao nhiêu rượu bay hơi thì cũng có bấy nhiêu rượu ngưng tụ, do đó mà lượng rượu không giảm. Với chai để hở miệng, quá trình bay hơi mạnh hơn ngưng tụ, nên rượu cạn dần.
Đáp án A
Luyện tập Bài 3 Khoa học tự nhiên 8 Chân trời sáng tạo
Học xong bài này các em cần biết:
– Nêu được khái niệm phản ứng hoá học, chất đầu và sản phẩm.
– Nêu được sự sắp xếp khác nhau của các nguyên tử trong phân tử chất đầu và sản phẩm.
– Chỉ ra được một số dấu hiệu chứng tỏ có phản ứng hoá học xảy ra.
– Nêu được khái niệm và đưa ra được ví dụ minh hoạ về phản ứng toả nhiệt, thu nhiệt.
– Trình bày được các ứng dụng phổ biến của phản ứng toả nhiệt (đốt cháy than, xăng, dầu).
3.1. Trắc nghiệm Bài 3 Khoa học tự nhiên 8 Chân trời sáng tạo
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm KHTN 8 Chân trời sáng tạo Bài 3 cực hay có đáp án và lời giải chi tiết.
-
Câu 1:
Phản ứng hóa học là gì?
- A. Quá trình biến đổi chất này thành chất khác
- B. Quá trình biến đổi từ chất rắn thành chất lỏng
- C. Quá trình biến đổi từ chất lỏng thành chất khí
- D. Quá trình biến đổi từ chất rắn thành chất khí
-
- A. Chất lỏng, chất rắn
- B. Chất rắn, chất lỏng
- C. Chất lỏng, chất khí
- D. Chất này, chất khác
-
- A. Carbon và oxygen
- B. Hydrogen và oxygen
- C. Nitrogen và oxygen
- D. Hydrogen và nitrogen
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 3 Khoa học tự nhiên 8 Chân trời sáng tạo
Các em có thể xem thêm phần hướng dẫn Giải bài tập KHTN 8 Chân trời sáng tạo Bài 3 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Khởi động trang 19 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Giải Câu hỏi 1 trang 19 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Giải Câu hỏi 2 trang 19 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Luyện tập trang 20 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Giải Câu hỏi 3 trang 20 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Giải Câu hỏi 4 trang 20 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Luyện tập trang 21 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Giải Câu hỏi 5 trang 21 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Giải Câu hỏi 6 trang 21 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Luyện tập trang 22 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Giải Câu hỏi 7 trang 22 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Vận dụng trang 22 SGK Khoa học tự nhiên 8 Chân trời sáng tạo – CTST
Hỏi đáp Bài 3 Khoa học tự nhiên 8 Chân trời sáng tạo
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Khoa học tự nhiên HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!