Hướng dẫn Giải bài tập Hóa học 11 CTST Bài 7 Sulfuric acid và muối sulfate môn Hóa học lớp 11 giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức.
-
Mở đầu trang 40 SGK Hóa học 11 Chân trời sáng tạo – CTST
Sulfuric acid là hoá chất hàng đầu trong nhiều ngành sản xuất, được mệnh danh là “máu” của các ngành công nghiệp. Sản lượng sulfuric acid của một quốc gia là một trong những chỉ số đánh giá sức mạnh công nghiệp hoá chất của quốc gia đó. Sulfuric acid có những tính chất và ứng dụng gì trong đời sống?

-
Thảo luận 1 trang 40 SGK Hóa học 11 Chân trời sáng tạo – CTST
Quan sát Hình 7.1 nhận xét màu, trạng thái của sulfuric acid ở điều kiện thường và cho biết tại sao sulfuric acid lại không bay hơi.

-
Thảo luận 2 trang 41 SGK Hóa học 11 Chân trời sáng tạo – CTST
Quan sát Hình 7.2, mô tả cấu tạo phân tử của H2SO4.
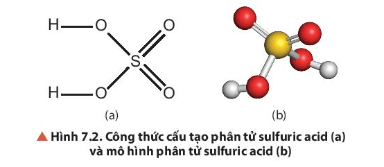
-
Thảo luận 3 trang 41 SGK Hóa học 11 Chân trời sáng tạo – CTST
Quan sát Hình 7.3, nêu hiện tượng, viết phương trình hoá học xảy ra (nếu có).

-
Thảo luận 4 trang 41 SGK Hóa học 11 Chân trời sáng tạo – CTST
Viết quá trình oxi hoá và quá trình khử trong phản ứng của dung dịch H2SO4 đặc với Cu ở Thí nghiệm 1.
-
Thảo luận 5 trang 41 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải thích hiện tượng xảy ra trong Thí nghiệm 2.
-
Hoạt động trang 42 SGK Hoá học 11 Chân trời sáng tạo – CTST
Viết phương trình hoá học khi cho dung dịch H2SO4 đặc tác dụng với KBr, C. Cho biết sản phẩm khử duy nhất là SO2.
-
Thảo luận 6 trang 43 SGK Hóa học 11 Chân trời sáng tạo – CTST
Quan sát Hình 7.5, mô tả cách pha loãng sulfuric acid. Giải thích.
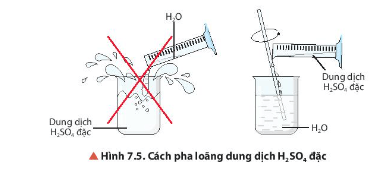
-
Thảo luận 7 trang 43 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hãy nêu nguyên tắc chung trong việc xử lí sơ bộ khi bỏng acid.
-
Thảo luận 8 trang 43 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hãy giải thích vì sao ở giai đoạn tạo ra SO3, người ta chọn điều kiện phản ứng ở nhiệt độ cao (450 oC – 500 oC).
-
Vận dụng trang 43 SGK Hoá học 11 Chân trời sáng tạo – CTST
Hãy cho biết giai đoạn nào trong quá trình sản xuất H2SO4 có nguy cơ cao gây ô nhiễm môi trường. Giải thích.
-
Thảo luận 9 trang 44 SGK Hóa học 11 Chân trời sáng tạo – CTST
Nêu ứng dụng trong đời sống, sản xuất của một số muối sulfate mà em biết.
-
Thảo luận 10 trang 44 SGK Hóa học 11 Chân trời sáng tạo – CTST
Quan sát Hình 7.6, trình bày cách nhận biết ion SO42-. Nêu hiện tượng xảy ra, viết phương trình hoá học.

-
Giải Bài 1 trang 45 SGK Hóa học 11 Chân trời sáng tạo – CTST
Tính chất nào sau đây không phải là tính chất của dung dịch sulfuric acid đặc?
A. Tính háo nước.
B. Tính oxi hoá.
C. Tính acid.
D. Tính khử.
-
Giải Bài 2 trang 45 SGK Hóa học 11 Chân trời sáng tạo – CTST
Để nhận biết anion có trong dung dịch K2SO4, không thể dùng thuốc thử nào sau đây?
A. Ba(OH)2.
B. BaCl2.
C. Ba(NO3)2.
D. MgCl2.
-
Giải Bài 3 trang 45 SGK Hóa học 11 Chân trời sáng tạo – CTST
Dung dịch sulfuric acid đặc được dùng làm khô khí nào trong số các khí sau: CO, H2, CO2, SO2, O2 và NH3. Giải thích.
-
Giải Bài 4 trang 45 SGK Hóa học 11 Chân trời sáng tạo – CTST
Cho các dung dịch không màu của mỗi chất sau: K2CO3, Na2SO4, Ba(NO3)2. Hãy trình bày cách phân biệt các dung dịch đã cho bằng phương pháp hoá học. Viết phương trình hoá học của các phản ứng xảy ra.
-
Giải Bài 5 trang 45 SGK Hóa học 11 Chân trời sáng tạo – CTST
Có 4 mẫu sau: dung dịch NaOH, dung dịch HCl, dung dịch H2SO4 và H2O được kí hiệu bằng các chữ cái A, B, C và D (không theo trình tự trên). Kết quả của những thí nghiệm nhận biết những mẫu này được ghi trong bảng sau:
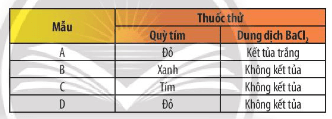
Hãy cho biết A, B, C và D là kí hiệu của những chất nào. Giải thích và viết phương trình hoá học của các phản ứng xảy ra.






