pH là chỉ số đo độ hoạt động (hoạt độ) của các ion H3O⁺ (H+) trong dung dịch và vì vậy người ta dùng chỉ số pH để xác định môi trường của một dung dịch. Vậy làm cách nào để biết một dung dịch có tính acid hay base? Cách tính pH của dung dịch là gì? pH có ứng dụng gì trong đời sống?
Chúng ta hãy cùng tìm hiểu nội dung lý thuyết và bài tập minh họa Bài 3: pH của dung dịch, chuẩn độ acid và base môn Hóa học lớp 11 Cánh Diều để tìm câu trả lời nhé!
Tóm tắt lý thuyết
1.1. pH của dung dịch, chất chỉ thị
a. pH của dung dịch
- Xét sự điện li của nước:
H2O \(\rightleftharpoons\) H+ + OH-
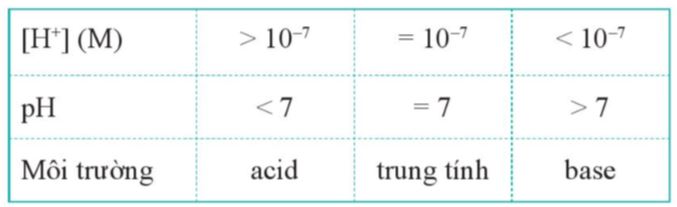
+ Ở 250C, nồng độ H+ và OH- trong nước vô cùng nhỏ: [H+] = [OH-] = 10-7 M. Vậy nước coi là chất không điện li.
+ Tích số ion của nước: Kw = [H+].[OH-] = 10-14
|
pH là đại lượng đặc trưng cho mức độ acid, base của một dung dịch. pH = -log[H+] hay [H+] = 10-pH |
- Giá trị pH càng nhỏ hơn 7, dung dịch có tính acid càng mạnh.
Ví dụ:
+ Hai dung dịch HCI và CH3COOH có cùng nồng độ 0,1 M nhưng nồng độ H+ trong dung dịch lần lượt là 0,1 M và 1,34.10-3 M; pH của hai dung dịch trên tương ứng là 1 và 2,87.
+ Điều này dẫn tới kết luận dung dịch HCl có tính acid mạnh hơn dung dịch CH,COOH.
+ Trong thực tế, HCl thuộc loại acid mạnh, CH3COOH thuộc loại acid yếu.
- Giá trị pH càng lớn hơn 7, dung dịch có tính base (tính kiềm) càng lớn.
Ví dụ: Dung dịch NaOH 0,1 M, nồng độ OH- trong dung dịch là 0,1 M nên nồng độ H+ của nó là 10-13, vậy nên NaOH có pH = 13, NaOH là một base mạnh.
b. Ý nghĩa của pH trong thực tiễn
- Nhiều quá trình hoá học trong tự nhiên, trong sản xuất và trong cơ thể sống xảy ra trong dung dịch nước với sự có mặt của các acid và base.
- Thông thường, các quá trình này diễn ra trong điều kiện ổn định về thành phần các chất và ion, trong đó có nồng độ H+.
- Do vậy, một sự thay đổi đáng kể về pH có thể dẫn tới những ảnh hưởng không mong muốn tới các quá trình này.
c. Xác định pH bằng chất chỉ thị
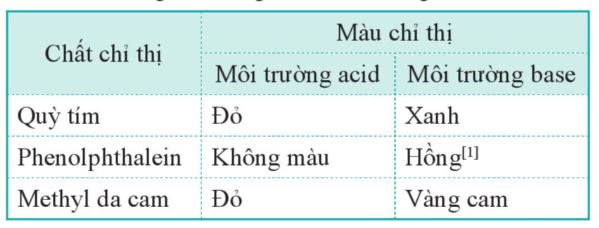
- Một số chất, chẳng hạn như quỳ tím, phenolphthalein, methyl da cam,... có màu sắc khác nhau trong môi trường acid và môi trường base.
- Những chất như vậy được gọi là chất chỉ thị acid — base.
Bảng 3.1. Màu của một số chất chỉ thị acid - base trong môi trường acid và base
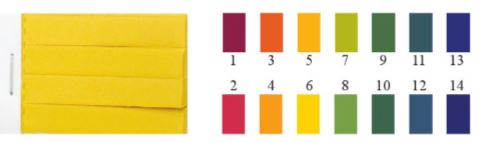
- Các chất chỉ thị như phenolphthalein, quỳ tím,... chỉ cho biết dung dịch có tính acid hay base. Để biết giá trị pH gần đúng của dung dịch, có thể sử dụng giấy chỉ thị pH(Hình 3.1).
Hình 3.1. Giấy chỉ thị pH và màu của giấy chỉ thị ở các giá trị pH khác nhau
|
- Phenolphthalein (C20H14O4) là một acid yếu có hai nguyên tử H có thể phân li thành H+. - Nếu kí hiệu chất này là H2R thì trong môi trường base, nó tồn tại chủ yếu ở dạng R2- có màu hồng; trong môi trường acid, nó tồn tại chủ yếu ở dạng H2R không có màu. - Trong môi trường pH > 12, phenolphthalein không có màu. |
1.2. Chuẩn độ dung dịch acid và base
|
Trong hoá học, chuẩn độ là một phương pháp dùng để xác định nồng độ của một chất trong dung dịch bằng một dung dịch khác đã biết nồng độ. |
- Về nguyên tắc, có thể xác định nồng độ của một dung dịch base mạnh bằng một dung dịch acid mạnh (hoặc ngược lại) đã biết trước nồng độ (thường gọi là dung dịch chuẩn) dựa theo phản ứng trung hoà:
H+ + OH- → H2O (1)
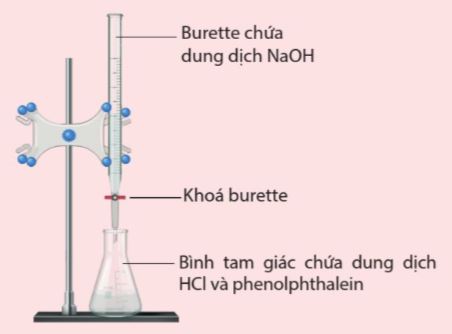
- Chẳng hạn, chuẩn độ dung dịch NaOH chưa biết nồng độ bằng dung dịch chuẩn HCl theo phản ứng
HCl + NaOH → NaCl + H2O
- Để nhận ra điểm tương đương, cần dùng thêm chất chỉ thị acid – base, thông qua sự thay đổi màu của chất chỉ thị.
- Những phản ứng giữa các acid mạnh và base mạnh trong dung dịch đều có chung bản chất (1).
- Chẳng hạn, chỉ thị phenolphthalein trong dung dịch HCl sẽ không có màu. Tại điểm tương đương, HCl hết nên nếu thêm tiếp NaOH, dung dịch sẽ chuyển sang màu hồng.
Hình 3.2. Bộ dụng cụ thí nghiệm chuẩn độ dung dịch NaOH bằng dung dịch HCl với chỉ thị phenolphthalein
Bài tập minh họa
Bài 1. Câu nào sai khi nói về pH và pOH của dung dịch?
A. [H+].[OH-] = 10-14
B. pH = lg[H+]
C. pH + pOH = 14
D. [H+] = 10-a pH = a
Hướng dẫn giải
B sai vì pH = - lg[H+]
Bài 2. Chỉ dùng quỳ tím, có thể nhận biết ba dung dịch riêng biệt nào sau đây?
A. HCl, NaNO3, Ba(OH)2
B. H2SO4, HCl,KOH.
C. H2SO4, NaOH, KOH
D. Ba(OH)2, NaCl, H2SO4
Hướng dẫn giải
Chỉ dùng quỳ tím, có thể nhận biết ba dung dịch riêng biệt Ba(OH)2, NaCl, H2SO4.
Hiện tượng:
- Quỳ tím chuyển màu đỏ: H2SO4
- Quỳ tím chuyển màu xanh: Ba(OH)2
- Quỳ tím không chuyển màu: NaCl
Luyện tập Bài 3 Hóa 11 Cánh Diều
Học xong bài học này, em có thể:
- Nêu được khái niệm và ý nghĩa của pH trong thực tiễn; nguyên tắc xác định nồng độ acid, base mạnh bằng phương pháp chuẩn độ.
- Viết được biểu thức tính pH (pH = - lg[H+] hoặc [H+] = 10-pH) và biết cách sử dụng các chất chỉ thị để xác định pH.
- Thực hiện được thí nghiệm chuẩn độ acid – base: Chuẩn độ dung dịch base mạnh (sodium hydroxide) bằng dung dịch acid mạnh (hydrochloric acid).
3.1. Trắc nghiệm Bài 3 Hóa 11 Cánh Diều
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 11 CD Bài 3 cực hay có đáp án và lời giải chi tiết.
-
- A. Dung dịch muối có pH < 7.
- B. Muối cố khả năng phản ứng với base.
- C. Muối vẫn còn hydrogen trong phân tử.
- D. Muối mà gốc acid vẫn còn hydrogen có khả năng phân li tạo proton trong nước.
-
- A. [H+].[OH-] = 10-14
- B. pH = lg[H+]
- C. pH + pOH = 14
- D. [H+] = 10-a pH = a
-
Câu 3:
Dung dịch có pH = 7 là:
- A. NH4Cl.
- B. CH3COONa.
- C. C6H5ONa.
- D. KClO3.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 3 Hóa 11 Cánh Diều
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 11 CD Bài 3 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Mở đầu trang 20 SGK Hóa học 11 Cánh diều – CD
Giải Câu hỏi 1 trang 21 SGK Hóa học 11 Cánh diều – CD
Giải Câu hỏi 2 trang 21 SGK Hóa học 11 Cánh diều – CD
Luyện tập 1 trang 21 SGK Hóa học 11 Cánh diều – CD
Luyện tập 2 trang 22 SGK Hóa học 11 Cánh diều – CD
Vận dụng 1 trang 22 SGK Hóa học 11 Cánh diều – CD
Luyện tập 3 trang 22 SGK Hóa học 11 Cánh diều – CD
Vận dụng 2 trang 22 SGK Hóa học 11 Cánh diều – CD
Giải Câu hỏi 3 trang 24 SGK Hóa học 11 Cánh diều – CD
Thí nghiệm trang 24 SGK Hóa học 11 Cánh diều – CD
Luyện tập 4 trang 24 SGK Hóa học 11 Cánh diều – CD
Luyện tập 5 trang 24 SGK Hóa học 11 Cánh diều – CD
Vận dụng 3 trang 24 SGK Hóa học 11 Cánh diều – CD
Giải Bài 1 trang 25 SGK Hóa học 11 Cánh diều – CD
Giải Bài 2 trang 25 SGK Hóa học 11 Cánh diều – CD
Giải Bài 3 trang 25 SGK Hóa học 11 Cánh diều – CD
Giải Bài 4 trang 25 SGK Hóa học 11 Cánh diều – CD
Hỏi đáp Bài 3 Hóa 11 Cánh Diều
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!