Trong đời sống thường ngày có rất nhiều quá trình hoà tan các chất vào nước, chẳng hạn hoà tan muối ăn vào nước hay hoà tan đường kính (C12H22O11) vào nước.
Vậy có sự khác biệt cơ bản nào khi muối ăn và đường tan trong nước?
Chúng ta cùng tìm hiểu vấn đề này thông qua nội dung lý thuyết và bài tập minh họa Bài 2: Sự điện li, thuyết Bronsted – Lowry về acid, base môn Hóa học lớp 11 Cánh Diều. Bài giảng gồm các nội dung chính về sự điện li, thuyết acid−base của Bronsted – Lowry, được HOC247 biên soạn và tổng hợp ngắn gọn, hi vọng sẽ giúp các em dễ dàng nắm được nội dung chính của bài.
Tóm tắt lý thuyết
1.1. Sự điện li, chất điện li và chất không điện li
|
Bản chất của dòng điện là dòng chuyển dời có hướng của các hạt mang điện như electron (ví dụ trong kim loại) hoặc ion (ví dụ trong dung dịch, trong muối nóng chảy,...). |
.png)
Hình 2.1. Minh hoạ dung dịch chất điện li và dung dịch chất không điện li
Hình 2.2. Thí nghiệm với dung dịch nước muối (a) và nước đường (b)
Khi hoà tan muối ăn và đường kính vào nước, diễn ra các quá trình như sau:
NaCl(s) → Na+(aq) + Cl-(aq) (1)
C12H22O11(s)→ C12H22O11(aq) (2)
|
Quá trình phân li các chất khi tan trong nước thành các ion được gọi là sự điện li. |
- Chất điện li là chất khi tan trong nước phân li thành các ion.
- Chất không điện li là chất khi tan trong nước không phân li thành các ion.
- Như vậy, quá trình (1) mô tả sự điện li và được gọi là phương trình điện li của muối ăn. Muối ăn thuộc loại chất điện li, đường kính thuộc loại chất không điện li.
- Trong thực tế, người ta thấy rằng:
+ Hầu hết các acid, base và muối tan được trong nước thuộc loại chất điện li.
+ Rất nhiều chất hữu cơ tan được trong nước như đường saccharose (C12H22O11) ethanol, glycerol... là những chất không điện li.
|
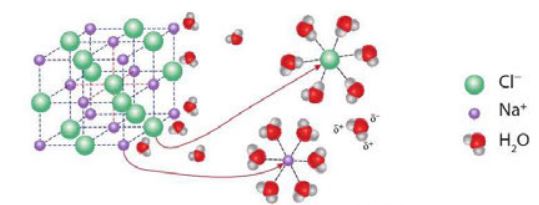
Nước đóng vai trò quan trọng trong sự điện li của một chất. Điều này được giải thích bởi nước là phân tử phân cực (các nguyên tử H mang một phần diện tích dương và nguyên tử O mang một phần diện tích âm) nên khi hoà tan một chất diện li vào nước, xuất hiện tương tác của nước với các ion. Tương tác này sẽ bứt các ion khỏi tinh thể (hoặc phân tử) để tan vào nước. |
Hình 2.3. Vai trò của nước trong sự điện li NaCl
1.2. Thuyết Bronsted – Lowry về acid – base
a. Thuyết Bronsted – Lowry về acid – base
|
Năm 1923, Bronsted và Lowry đã đề xuất thuyết về acid — base như sau: Acid là những chất có khả năng cho H+, base là những chất có khả năng nhận H+. |
|
Theo thuyết Arrhenius (A-rê-ni-ut), acid là những chất khi tan trong nước. phân li ra H+ (proton), base là những chất khi tan trong nước phân li ra OH-. |
b. Acid mạnh/ base mạnh và acid yếu/ base yếu
- Acid mạnh và base mạnh phân li hoàn toàn trong nước (mũi tên một chiều →) nên không tồn tại chung phân tử trong nước.
Ví dụ: HCl → H+ + Cl-
+ Các acid HCl, HNO3, H2SO4.... là acid mạnh và các base NaOH, Ba(OH)2, Ca(OH)2,... là base mạnh.
- Acid yếu và base yếu phân li một phần trong nước (mũi tên thuận nghịch \(\rightleftharpoons\)).
Ví dụ: CH3COOH \(\rightleftharpoons\) CH3COO- + H+
+ Các acid CH3COOH, H2CO3, H2SO3 là acid yếu và các gốc acid tương ứng CH3COO-, CO32-, SO32- ... là base.
- Theo thuyết Bronsted — Lowry, nhiều ion như Fe3+, Al3+, CO32-... sẽ đóng vai trò là acid hoặc base trong nước, bởi chúng tác dụng một phần với nước.
Ví dụ:
Al3+ + 3H2O \(\rightleftharpoons\) Al(OH)3 + 3H+ (7)
CO32- + 3H2O \(\rightleftharpoons\) HCO3- + OH- (8a)
HCO3- + H2O \(\rightleftharpoons\) H2CO3 + OH- (8b)
|
Các phản ứng (7), (8a) và (8b) còn được gọi là phản ứng thuỷ phân (tác dụng với nước) của ion Al3+ và ion CO32-,... |
Bài tập minh họa
Bài 1. Chất nào sau đây không dẫn điện được ?
A. KCl rắn, khan.
B. NaOH nóng chảy.
C. CaCl2 nóng chảy.
D. HBr hòa tan trong nước
Hướng dẫn giải
Chất không dẫn điện được là KCl rắn, khan do KCl rắn, khan tồn tại dưới dạng mạng tinh thể ion, rất bền vững, không phân li ra được ion dương và ion âm (di chuyển tự do) nên không có khả năng dẫn điện.
⇒ Chọn A
Bài 2. Cho các chất sau: K3PO4, H2SO4, HClO, HNO2, NH4Cl, Mg(OH)2. Các chất điện li yếu là:
A. HClO, HNO2, K3PO4.
B. HClO, HNO2, Mg(OH)2.
C. Mg(OH)2, NH4Cl, HNO2
D. Mg(OH)2, HNO2, H2SO4.
Hướng dẫn giải
Các chất H2SO4 , K3PO4, NH4Cl là những chất điện li mạnh
⇒ Loại A, C, D.
Vậy các chất điện li yếu là: HClO, HNO2, Mg(OH)2.
Luyện tập Bài 2 Hóa 11 Cánh Diều
Học xong bài học này, em có thể:
- Nêu được khái niệm sự điện li, chất điện li, chất không điện li.
- Trình bày được thuyết Bronsted – Lowry (Brôn-stet – Lau-ri) về acid – base.
- Trình bày được ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+ và CO32-.
3.1. Trắc nghiệm Bài 2 Hóa 11 Cánh Diều
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 11 CD Bài 2 cực hay có đáp án và lời giải chi tiết.
-
- A. HNO3, Cu(NO3)2, H3PO4, Ca(NO3)2.
- B. CaCl2, CuSO4, H2S, HNO3
- C. H2SO4, NaCl, KNO3, Ba(NO3)2
- D. KCl, H2SO4, HNO2, MgCl2
-
- A. 8
- B. 7
- C. 9
- D. 10
-
- A. CH3COOH
- B. NaCl
- C. H2O
- D. HF
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 2 Hóa 11 Cánh Diều
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 11 CD Bài 2 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Mở đầu trang 15 SGK Hóa học 11 Cánh diều – CD
Giải Câu hỏi 1 trang 16 SGK Hóa học 11 Cánh diều – CD
Luyện tập 1 trang 16 SGK Hóa học 11 Cánh diều – CD
Luyện tập 2 trang 16 SGK Hóa học 11 Cánh diều – CD
Giải Câu hỏi 2 trang 17 SGK Hóa học 11 Cánh diều – CD
Luyện tập 3 trang 17 SGK Hóa học 11 Cánh diều – CD
Giải Câu hỏi 3 trang 17 SGK Hóa học 11 Cánh diều – CD
Luyện tập 4 trang 18 SGK Hóa học 11 Cánh diều – CD
Giải Câu hỏi 4 trang 18 SGK Hóa học 11 Cánh diều – CD
Vận dụng trang 19 SGK Hóa học 11 Cánh diều – CD
Giải Bài 1 trang 19 SGK Hóa học 11 Cánh diều – CD
Giải Bài 2 trang 19 SGK Hóa học 11 Cánh diều – CD
Giải Bài 3 trang 19 SGK Hóa học 11 Cánh diều – CD
Hỏi đáp Bài 2 Hóa 11 Cánh Diều
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!





%20v%C3%A0%20n%C6%B0%E1%BB%9Bc%20%C4%91%C6%B0%E1%BB%9Dng%20(b).JPG)