Catechin là một hợp chất phenol có trong lá chè xanh. Catechin có tác dụng chống oxi hoá, diệt khuẩn, kháng viêm, ngăn ngừa một số bệnh về tim mạch, cao huyết áp, tiêu hoá, làm chậm quá trình lão hoá,... Vậy hợp chất phenol là gì và có các tính chất đặc trưng nào? Các em hãy cùng HOC247 tìm hiểu qua nội dung Bài 21 Phenol môn Hoá học 11 Kết nối tri thức nhé!
Tóm tắt lý thuyết
1.1. Khái niệm
|
Phenol là những hợp chất hữu cơ trong phân tử có nhóm –OH liên kết trực tiếp với nguyên tử carbon của vòng benzene. |
– Hợp chất phenol đơn giản nhất có công thức là C6H5OH cũng có tên gọi riêng là phenol.
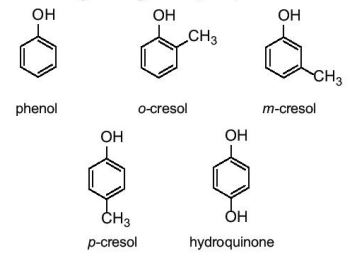
– Tên thông thường của một số phenol:
1.2. Đặc điểm cấu tạo
Hình 21.1. Công thức cấu tạo (a) và mô hình phân tử (b) của phenol
– Trong phân tử phenol, do ảnh hưởng của vòng benzene nên liên kết O–H của phenol phân cực mạnh hơn so với alcohol, vì vậy phenol thể hiện tính acid yếu.
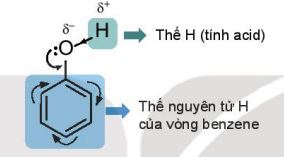
– Ngoài ra, do có vòng benzene nên phenol có thể tham gia phản ứng thế nguyên tử hydrogen của vòng benzene.
1.3. Tính chất vật lí
– Ở điều kiện thường, phenol là chất rắn không màu, nóng chảy ở 43°C, sôi ở 181,8°C.
– Phenol ít tan trong nước ở điều kiện thường (độ tan trong nước ở 25°C: 8,42 g/100 g nước), tan nhiều khi đun nóng (tan vô hạn ở 66°C); tan tốt trong các dung môi hữu cơ như ethanol, ether và acetone.
– Phenol độc và có thể gây bỏng khi tiếp xúc với da nên phải cần thận khi sử dụng.
1.4. Tính chất hoá học
a. Phản ứng thế nguyên tử H của nhóm –OH (tính acid của phenol)
– Trong dung dịch nước, phenol phân li theo cân bằng sau:
C6H5OH + H2O \(\rightleftharpoons\) C6H5O + H3O+
ion phenolate
|
Phenol là một acid yếu, dung dịch phenol không làm đổi màu quỳ tím. |
– Phenol có thể phản ứng được với kim loại kiềm, dung dịch base, muối sodium carbonate,... Ví dụ:
Ví dụ:
C6H5OH + NaOH → C6H5ONa + H2O
C6H5OH + Na2CO3 \(\rightleftharpoons\) C6H5ONa+ NaHCO3 (1)
(1) Phenol có tính acid mạnh hơn nấc hai của carbonic acid (H2CO3) nên có thể phản ứng được với muối carbonate.
b. Phản ứng thế ở vòng thơm
|
Phenol có thể tham gia phản ứng thế nguyên tử hydrogen của vòng benzene. Phản ứng thế ưu tiên vào vị trí 2, 4 và 6 (ortho và para). |
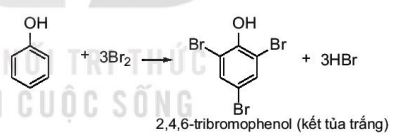
Phản ứng bromine hoá
|
Phenol phản ứng với nước bromine tạo sản phẩm thế 2,4,6–tribromophenol kết tủa màu trắng. |
– Do ảnh hưởng của nhóm –OH, phản ứng thế nguyên tử hydrogen ở vòng benzene của phenol xảy ra dễ dàng hơn so với benzene.
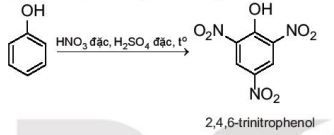
Phản ứng nitro hoá
|
Phenol phản ứng với dung dịch nitric acid đặc trong dung dịch sulfuric acid đặc tạo thành sản phẩm 2,4,6–trinitrophenol (picric acid): |
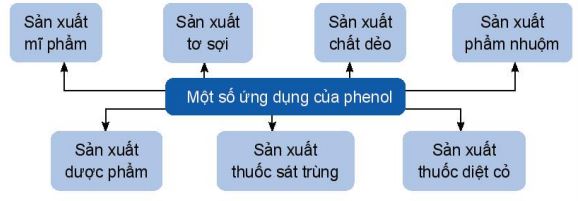
1.5. Ứng dụng
1.6. Điều chế
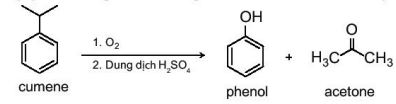
|
Phenol được tổng hợp từ cumene (isopropylbenzene) bằng phản ứng oxi hoá bởi oxygen rồi thuỷ phân trong môi trường acid thu được hai sản phẩm là phenol và acetone |
–Hiện nay, phần lớn phenol và acetone đều được sản xuất trong công nghiệp theo phương pháp này.
– Ngoài ra, phenol còn được điều chế từ nhựa than đá.
Bài tập minh họa
Bài 1. Ảnh hưởng của nhóm OH đến nhân benzene được chứng minh bởi phản ứng nào?
A. Phản ứng của phenol với dung dịch NaOH.
B. Phản ứng của phenol với nước bromine.
C. Phản ứng của phenol với Na.
D. Phản ứng của phenol với andehyde formic.
Hướng dẫn giải
Ảnh hưởng của nhóm –OH đến nhân benzene : Nhóm –OH đẩy e vào vòng benzene làm cho mật độ điện tích âm tại vị trí o, p tăng, các tác nhân thế mang điện tích dương như Br+, NO2+ dễ tấn công vào o, p.
Chọn phản ứng với dung dịch Br2
Bài 2. Hãy chọn phát biểu sai:
A. Phenol có tính acid yếu nhưng mạnh hơn H2CO3.
B. Phenol là chất rắn kết tinh dễ bị oxi hóa trong không khí.
C. Khác với benzene, phenol phản ứng dễ dàng với Br2 tạo kết tủa trắng.
D. Nhóm –OH và gốc phenyl ở phenol có ảnh hưởng qua lại lẫn nhau.
Hướng dẫn giải
Phenol có tính acid yếu hơn cả H2CO3.
C6H5OH + Na2CO3 \(\rightleftharpoons\) C6H5ONa+ NaHCO3 (1)
Luyện tập Bài 21 Hóa 11 Kết Nối Tri Thức
Học xong bài học này, em có thể:
– Nêu được khái niệm về phenol, tên gọi, công thức cấu tạo một số phenol đơn giản, đặc điểm cấu tạo và hình dạng phân tử của phenol.
– Nêu được tính chất vật lí của phenol.
– Trình bày được tính chất hoá học cơ bản; giải thích được tính chất hoá học; ứng dụng và điều chế phenol.
3.1. Trắc nghiệm Bài 21 Hóa 11 Kết Nối Tri Thức
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 11 KNTT Bài 21 cực hay có đáp án và lời giải chi tiết.
-
- A. 6
- B. 8
- C. 4
- D. 5
-
- A. Chỉ có (1)
- B. (2) và (3)
- C. Chỉ có (2)
- D. Chỉ có (3)
-
- A. (1) < (2) < (3)
- B. (2) < (1) < (3)
- C. (3) < (2) < (1)
- D. (2) < (3) < (1)
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 21 Hóa 11 Kết Nối Tri Thức
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 11 KNTT Bài 21 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Mở đầu trang 129 SGK Hóa học 11 Kết nối tri thức – KNTT
Hoạt động 1 trang 131 SGK Hóa học 11 Kết nối tri thức – KNTT
Giải Câu hỏi 1 trang 131 SGK Hóa học 11 Kết nối tri thức – KNTT
Hoạt động 2 trang 131 SGK Hóa học 11 Kết nối tri thức – KNTT
Giải Câu hỏi 2 trang 132 SGK Hóa học 11 Kết nối tri thức – KNTT
Giải Câu hỏi 3 trang 132 SGK Hóa học 11 Kết nối tri thức – KNTT
Hoạt động trang 132 SGK Hóa học 11 Kết nối tri thức – KNTT
Hoạt động trang 133 SGK Hóa học 11 Kết nối tri thức – KNTT
Hỏi đáp Bài 21 Hóa 11 Kết Nối Tri Thức
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!





%20v%C3%A0%20m%C3%B4%20h%C3%ACnh%20ph%C3%A2n%20t%E1%BB%AD%20(b)%20c%E1%BB%A7a%20phenol.JPG)
.JPG)