Từ xa xưa con người đã biết lên men các loại ngũ cốc, hoa quả để tạo ra các đồ uống có cồn (có chứa ethanol – một alcohol quen thuộc). Ngày nay, alcohol được sử dụng phổ biến trong nhiều lĩnh vực khác nhau như làm dung môi, nguyên liệu hoá học, nhiên liệu, xăng sinh học,... Vậy alcohol là gì và có những tính chất đặc trưng nào?
Hãy cùng HOC247 tìm hiểu nội dung lý thuyết và bài tập của Bài 20 Alcohol trong chương trình môn Hóa học lớp 11 Kết Nối Tri Thức để hiểu rõ hơn về khái niệm, danh pháp của alcohol, đặc điểm cấu tạo, tính chất vật lí, hoá học, ứng dụng và phương pháp điều chế alcohol nhé!
Tóm tắt lý thuyết
1.1. Khái niệm, danh pháp
a. Khái niệm
|
Alcohol là những hợp chất hữu cơ trong phân tử có chứa nhóm hydroxy (–OH) liên kết với nguyên tử carbon no. |
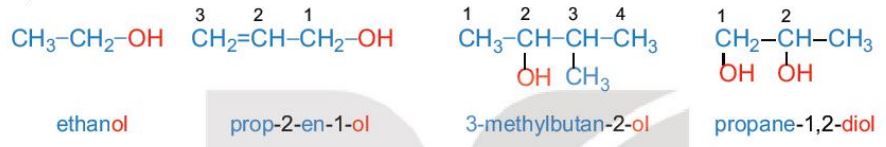
- Alcohol no, đơn chức, mạch hở trong phân tử có một nhóm –OH liên kết với gốc alkyl, có công thức tổng quát là CnH2n+1OH (n ≥ 1).
Ví dụ:
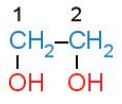
- Nếu alcohol có hai hay nhiều nhóm –OH thì các alcohol đó được gọi là các alcohol đa chức (polyalcohol).
Ví dụ:
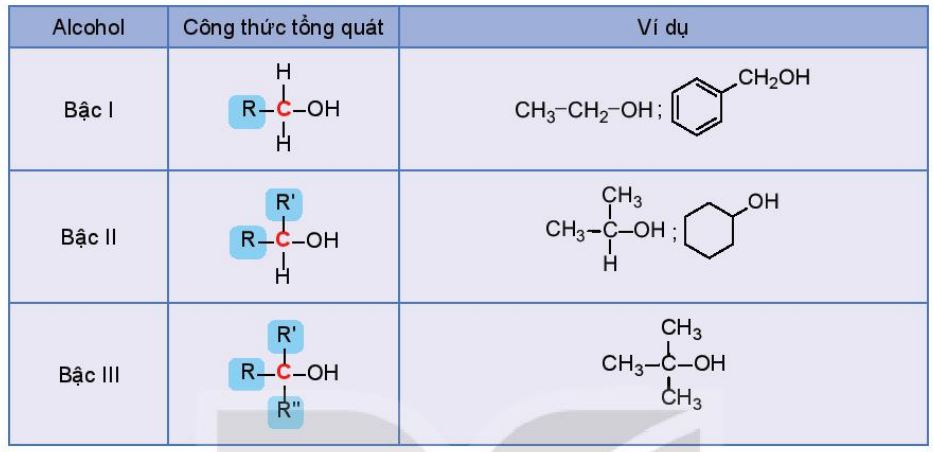
- Bậc của alcohol là bậc của nguyên tử carbon liên kết với nhóm hydroxy. Ta có alcohol bậc I, alcohol bậc II và alcohol bậc III
Bảng 20.1. Bậc của alcohol
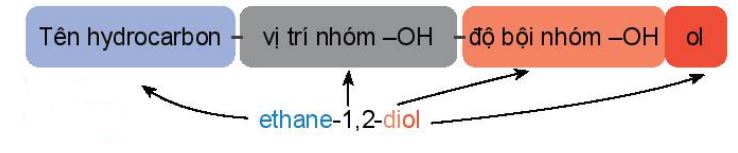
b. Danh pháp
Danh pháp thay thế
- Tên theo danh pháp thay thế của monoalcohol:
- Nếu nhóm –OH chỉ có một vị trí duy nhất thì không cần số chỉ vị trí nhóm –OH.
- Mạch carbon được ưu tiên đánh số từ phía gần nhóm –OH hơn.
- Nếu mạch carbon có nhánh thì cần thêm tên nhánh ở phía trước.
– Nếu có nhiều nhóm –OH thì cần thêm độ bội (di, tri,...) trước “ol” và giữ nguyên tên
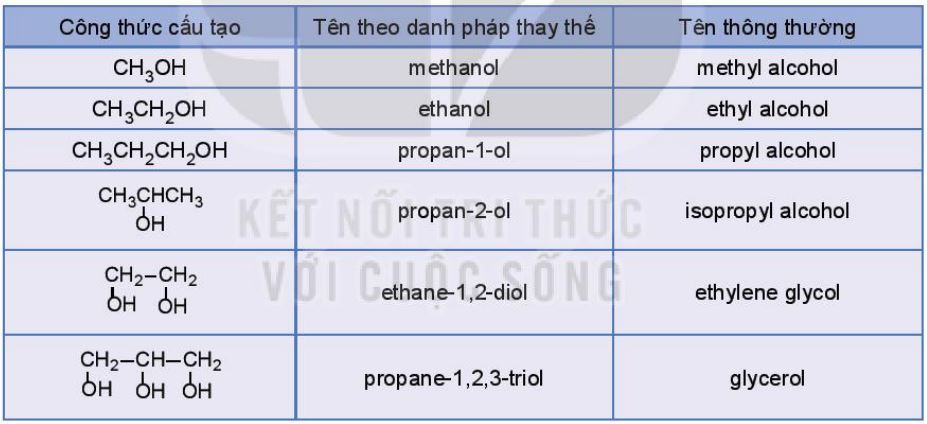
Bảng 20.2. Tên theo danh pháp thay thế và tên thông thường của một số alcohol
1.2. Đặc điểm cấu tạo
Hình 20.1. Mô hình phân tử của methanol (a) và ethanol (b)
- Trong phân tử alcohol, các liên kết O–H và C–O đều phân cực về phía nguyên tử oxygen do oxygen có độ âm điện lớn.
- Vì vậy, trong các phản ứng hoá học, alcohol thường bị phân cắt ở liên kết O–H hoặc liên kết C−O.
1.3. Tính chất vật lí
- Ở điều kiện thường, các alcohol no, đơn chức từ C1 đến C12 ở trạng thái lỏng, các alcohol từ C13 trở lên ở trạng thái rắn.
- Các polyalcohol như ethylene glycol, glycerol là chất lỏng sánh, nặng hơn nước và có vị ngọt.
- Alcohol có nhiệt độ sôi cao hơn các hydrocarbon, dẫn xuất halogen có phân tử khối tương đương và dễ tan trong nước do các phân tử alcohol có thể tạo liên kết hydrogen với nhau và với nước.
Hình 20.2. Liên kết hydrogen giữa các phân tử ethanol (a) và giữa ethanol với nước (b)
- Khi số nguyên tử carbon trong phân tử tăng lên, độ tan trong nước của alcohol giảm nhanh do gốc hydrocarbon là phần kị nước tăng lên.
Bảng 20.3. Nhiệt độ sôi và độ tan của một số alcohol
1.4. Tính chất hoá học
a. Phản ứng thế nguyên tử H của nhóm –OH
|
Liên kết O–H phân cực nên trong một số phản ứng, nguyên tử hydrogen trong nhóm hydroxy có thể bị thay thế. |
- Alcohol phản ứng với các kim loại mạnh như sodium, potassium giải phóng khí hydrogen:
2R-OH + 2Na → 2RONa + H2
b. Phản ứng tạo ether
Khi đun nóng alcohol với H2SO4 đặc ở nhiệt độ thích hợp thì thu được ether.
Ví dụ:
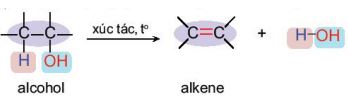
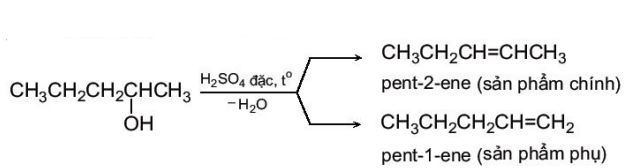
c. Phản ứng tạo alkene
- Khi cho hơi alcohol no, đơn chức, mạch hở đi qua bột Al2O3 nung nóng hoặc đun alcohol với H2SO4 đặc, H3PO4 đặc, alcohol bị tách nước tạo thành alkene:
Ví dụ: C2H5OH \(\xrightarrow{{{H}_{2}}S{{O}_{4}}\,đặc,\ {{180}^{0}}C}\) CH2=CH2 + H2O
|
Phản ứng tách nước của alcohol tạo alkene ưu tiên theo quy tắc Zaitsev: Trong phản ứng tách nước của alcohol, nhóm –OH bị tách ưu tiên cùng với nguyên tử hydrogen ở carbon bên cạnh có bậc cao hơn. |
Ví dụ:
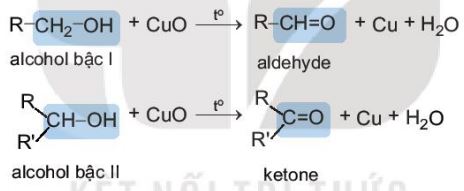
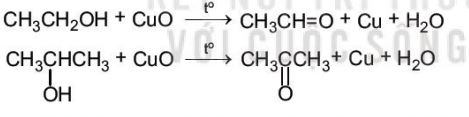
d. Phản ứng oxi hoá
Oxi hoá không hoàn toàn
- Khi phản ứng với các chất oxi hoá (ví dụ: CuO), các alcohol bị oxi hoá không hoàn toàn tạo thành các sản phẩm khác nhau tuỳ theo bậc của alcohol:
+ alcohol bậc I bị oxi hoá thành aldehyde
+ alcohol bậc II bị oxi hoá thành ketone
+ alcohol bậc III không bị oxi hoá trong điều kiện này.
Ví dụ:
Phản ứng cháy của alcohol
|
Các alcohol có thể bị đốt cháy trong không khí tạo thành carbon dioxide, hơi nước và toả nhiệt: CnH2n+1OH + \(\frac{3n}{2}\)O2 \(\xrightarrow{{{t}^{o}}}\) 2nCO2 + (n+1)H2O |
Ví dụ: C2H5OH(l) + 3O2(g) \(\xrightarrow{{{t}^{o}}}\) 2CO2(g) + 3H2O(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) = -1367 kJ/mol
Ethanol được sử dụng phổ biến làm nhiên liệu cho đèn cồn, bếp cồn hoặc phối trộn với xăng để làm nhiên liệu cho động cơ đốt trong.
e. Phản ứng riêng của polyalcohol với Cu(OH)2
- Các polyalcohol có các nhóm -OH liền kề như ethylene glycol, glycerol có thể tác dụng với copper(II) hydroxide tạo dung dịch màu xanh lam đậm.
ethylene glycol copper (II) hydroxide
- Vì vậy, phản ứng này có thể dùng để nhận biết các polyalcohol có các nhóm –OH liền kề.
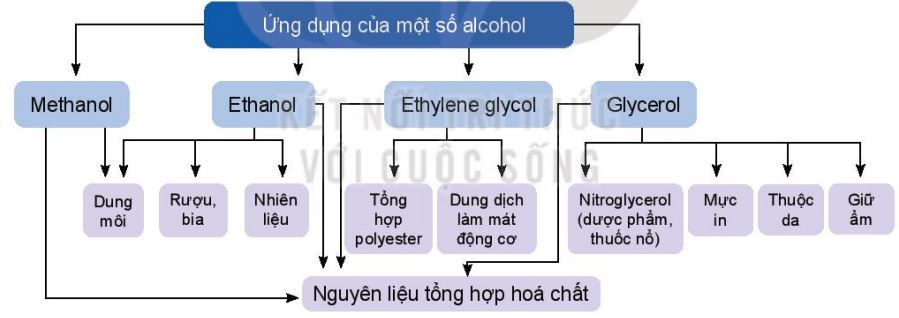
1.5. Ứng dụng
a. Ứng dụng của một số alcohol
b. Ảnh hưởng của rượu, bia và đồ uống có cồn đến sức khoẻ con người
- Sau khi uống đồ uống có cồn, ethanol sẽ được hấp thụ vào cơ thể thông qua hệ tiêu hoá.
- Một phần ethanol sẽ được hấp thụ tại dạ dày, ruột non, thẩm thấu vào máu và được đưa đến các cơ quan trong cơ thể, phần còn lại sẽ được chuyển hoá ở gan.
- Việc lạm dụng rượu, bia quá mức sẽ gây ảnh hưởng nghiêm trọng đến sức khoẻ con người như tổn thương hệ thần kinh, rối loạn tâm thần, viêm gan, xơ gan, viêm loét dạ dày, viêm tụy,...
- Trong thời gian mang thai, nếu người mẹ lạm dụng rượu, bia thì sẽ gây độc cho thai nhi, có thể gây dị tật ở trẻ.
1.6. Điều chế
a. Hydrate hoá alkene
|
Các alcohol có thể được điều chế bằng phản ứng hydrate hoá alkene. Phương pháp này được sử dụng phổ biến trong công nghiệp để điều chế ethanol CH2=CH2 + H2O \(\xrightarrow{{{H}_{3}}P{{O}_{4}},\ {{t}^{0}}}\) C2H5OH |
b. Điều chế ethanol bằng phương pháp sinh hoá
- Khi lên men tinh bột, enzyme sẽ phân giải tinh bột (C6H10O5)n thành glucose C6H12O6, sau đó glucose sẽ chuyển hoá thành ethanol C2H5OH:
(C6H10O5)n + nH2O \(\xrightarrow{enzyme}\) nC6H12O6
C6H12O6 \(\xrightarrow{enzyme}\) 2C2H5OH + 2CO2
- Ngoài các sản phẩm chứa tinh bột (gạo, ngô, sắn,...), người ta còn sử dụng các phế phẩm của công nghiệp đường, chế phẩm thuỷ phân cellulose,... để sản xuất ethanol.
- Phương pháp sinh hoá được sử dụng phổ biến để sản xuất các đồ uống có cồn, điều chế ethanol làm nhiên liệu sinh học.
c. Điều chế glycerol
- Trong công nghiệp, glycerol được tổng hợp từ propylene theo sơ đồ sau:
- Ngoài ra, glycerol còn thu được khi thuỷ phân chất béo trong quá trình sản xuất xà phòng.
Bài tập minh họa
Bài 1. Rượu pha chế dùng cồn công nghiệp có chứa hàm lượng methanol cao, có thể gây ngộ độc nguy hiểm đến tính mạng. Công thức phân tử của methanol là
A. C2H5OH
B. C3H5OH
C. CH3OH
D. C3H7OH
Hướng dẫn giải
Methanol: CH3OH.
Bài 2. Phản ứng nào sau đây không xảy ra:
A. C2H5OH + CH3COOH
B. C2H5OH + HBr
C. C2H5OH + O2
D. C2H5OH + NaOH
Hướng dẫn giải
A. C2H5OH + CH3COOH \(\rightleftharpoons\) CH3COOC2H5 + H2O
B. C2H5OH + HBr → C2H5Br + H2O
C. C2H5OH + 3O2 \(\xrightarrow{{{t}^{o}}}\) 2CO2 + 3H2O
D. C2H5OH + NaOH
C2H5OH không phản ứng với NaOH.
Luyện tập Bài 20 Hóa 11 Kết Nối Tri Thức
Học xong bài học này, em có thể:
- Nêu được khái niệm alcohol; đặc điểm liên kết và hình dạng phân tử của methanol, ethanol.
- Viết được công thức cấu tạo, gọi tên theo danh pháp thay thế một số alcohol đơn giản, tên thông thường của một vài alcohol thường gặp.
- Trình bày được đặc điểm về tính chất vật lí; tính chất hoá học; ứng dụng của alcohol và phương pháp điều chế ethanol.
3.1. Trắc nghiệm Bài 20 Hóa 11 Kết Nối Tri Thức
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 11 KNTT Bài 20 cực hay có đáp án và lời giải chi tiết.
-
- A. H2SO4 đặc, 120oC
- B. H2SO4 loãng, 140oC
- C. H2SO4 đặc, 180oC
- D. H2SO4 đặc, 140oC
-
Câu 2:
Tên thay thế của C2H5OH là
- A. ethyl alcohol.
- B. methyl alcohol.
- C. ethanol.
- D. methanol.
-
- A. 4
- B. 5
- C. 6
- D. 7
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 20 Hóa 11 Kết Nối Tri Thức
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 11 KNTT Bài 20 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Mở đầu trang 119 SGK Hóa học 11 Kết nối tri thức – KNTT
Giải Câu hỏi 1 trang 120 SGK Hóa học 11 Kết nối tri thức – KNTT
Giải Câu hỏi 2 trang 121 SGK Hóa học 11 Kết nối tri thức – KNTT
Giải Câu hỏi 3 trang 121 SGK Hóa học 11 Kết nối tri thức – KNTT
Hoạt động trang 122 SGK Hóa học 11 Kết nối tri thức – KNTT
Giải Câu hỏi 4 trang 123 SGK Hóa học 11 Kết nối tri thức – KNTT
Giải Câu hỏi 5 trang 124 SGK Hóa học 11 Kết nối tri thức – KNTT
Giải Câu hỏi 6 trang 124 SGK Hóa học 11 Kết nối tri thức – KNTT
Thí nghiệm trang 124 SGK Hóa học 11 Kết nối tri thức – KNTT
Thí nghiệm trang 125 SGK Hóa học 11 Kết nối tri thức – KNTT
Giải Câu hỏi 7 trang 125 SGK Hóa học 11 Kết nối tri thức – KNTT
Giải Câu hỏi 8 trang 125 SGK Hóa học 11 Kết nối tri thức – KNTT
Giải Câu hỏi 9 trang 127 SGK Hóa học 11 Kết nối tri thức – KNTT
Giải Câu hỏi 10 trang 127 SGK Hóa học 11 Kết nối tri thức – KNTT
Hỏi đáp Bài 20 Hóa 11 Kết Nối Tri Thức
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!


%20v%C3%A0%20ethanol%20(b).JPG)
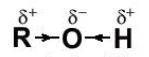
%20v%C3%A0%20gi%E1%BB%AFa%20ethanol%20v%E1%BB%9Bi%20n%C6%B0%E1%BB%9Bc%20(b).JPG)
.JPG)
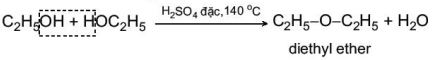
2%20v%C3%A0%20alcohol%20%C4%91a%20ch%E1%BB%A9c.JPG)