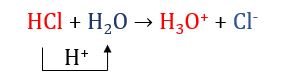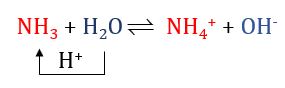Mß╗Øi c├Īc em c├╣ng tham khß║Żo l├Į thuyß║┐t v├Ā b├Āi tß║Łp minh hß╗Źa B├Āi 2: C├ón bß║▒ng trong dung dß╗ŗch nŲ░ß╗øc m├┤n H├│a hß╗Źc lß╗øp 11 Kß║┐t Nß╗æi Tri Thß╗®c. B├Āi giß║Żng gß╗ōm c├Īc nß╗Öi dung ch├Łnh vß╗ü sß╗▒ ─æiß╗ćn li, thuyß║┐t acidŌłÆbase cß╗¦a Br├Ėnsted ŌĆō Lowry, kh├Īi niß╗ćm pH v├Ā ├Į ngh─®a cß╗¦a pH trong thß╗▒c tiß╗ģn, sß╗▒ thuß╗Ę ph├ón cß╗¦a c├Īc ion, chuß║®n ─æß╗Ö acidŌłÆbase ─æŲ░ß╗Żc HOC247 bi├¬n soß║Īn, hi vß╗Źng sß║Į gi├║p c├Īc em dß╗ģ d├Āng nß║»m ─æŲ░ß╗Żc nß╗Öi dung ch├Łnh cß╗¦a b├Āi.
T├│m tß║»t l├Į thuyß║┐t
1.1. Sß╗▒ ─æiß╗ćn li
a. Hiß╗ćn tŲ░ß╗Żng ─æiß╗ćn li
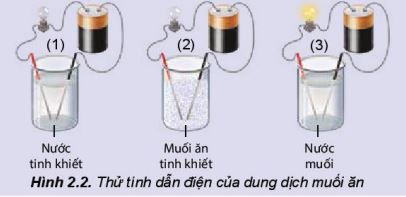
ŌłÆ X├®t th├Ł nghiß╗ćm thß╗Ł t├Łnh dß║½n ─æiß╗ćn cß╗¦a nŲ░ß╗øc, muß╗æi ─ān v├Ā dung dß╗ŗch muß╗æi ─ān nhŲ░ h├¼nh 2.2.
ŌłÆ Ta thß║źy:
+ Cß╗æc (1) ─æ├©n kh├┤ng s├Īng
+ Cß╗æc (2) ─æ├©n kh├┤ng s├Īng
+ Cß╗æc (3) ─æ├©n s├Īng
ŌłÆ Kß║┐t luß║Łn:
+ NŲ░ß╗øc tinh khiß║┐t, muß╗æi ─ān tinh khiß║┐t kh├┤ng dß║½n ─æiß╗ćn
+ Dung dß╗ŗch nŲ░ß╗øc muß╗æi NaCl dß║½n ─æiß╗ćn, chß╗®ng tß╗Å trong dung dß╗ŗch c├│ hß║Īt mang ─æiß╗ćn.
|
Qu├Ī tr├¼nh ph├ón li c├Īc chß║źt trong nŲ░ß╗øc tß║Īo th├Ānh ion ─æŲ░ß╗Żc gß╗Źi l├Ā sß╗▒ ─æiß╗ćn li. Nhß╗»ng chß║źt khi tan trong nŲ░ß╗øc ph├ón li ra ion ─æŲ░ß╗Żc gß╗Źi l├Ā chß║źt ─æiß╗ćn li. |
b. Chß║źt ─æiß╗ćn li
Chß║źt ─æiß╗ćn li v├Ā chß║źt kh├┤ng ─æiß╗ćn li
ŌłÆ C├Īc chß║źt nhŲ░ hydrochloric acid, sodium hydroxide,... tan trong nŲ░ß╗øc ph├ón li ra c├Īc ion n├¬n ch├║ng l├Ā chß║źt ─æiß╗ćn li. Saccarose, ethanol,... kh├┤ng ph├ón li ra c├Īc ion n├¬n ch├║ng l├Ā chß║źt kh├┤ng ─æiß╗ćn li.
ŌłÆ Sß╗▒ ph├ón li mß╗Öt chß║źt th├Ānh c├Īc ion mang ─æiß╗ćn tr├Īi dß║źu trong dung dß╗ŗch ─æŲ░ß╗Żc biß╗āu diß╗ģn bß║▒ng phŲ░ŲĪng tr├¼nh ─æiß╗ćn li.
V├Ł dß╗ź: NaOH(aq) \(\to\) Na+(aq) + OHŌłÆ(aq)
HCl(aq) \(\to\) H+(aq) + Cl-(aq).
Chß║źt ─æiß╗ćn li mß║Īnh v├Ā chß║źt ─æiß╗ćn li yß║┐u
ŌłÆ Dß╗▒a v├Āo mß╗®c ─æß╗Ö ph├ón li th├Ānh c├Īc ion, chß║źt ─æiß╗ćn li ─æŲ░ß╗Żc chia th├Ānh hai loß║Īi:
|
Chß║źt ─æiß╗ćn li mß║Īnh l├Ā chß║źt khi tan trong nŲ░ß╗øc, hß║¦u hß║┐t c├Īc ph├ón tß╗Ł chß║źt tan ─æß╗üu ph├ón li ra ion. |
Chß║źt ─æiß╗ćn li mß║Īnh l├Ā chß║źt khi tan trong nŲ░ß╗øc, hß║¦u hß║┐t c├Īc ph├ón tß╗Ł chß║źt tan ─æß╗üu ph├ón li ra ion.
+ C├Īc chß║źt ─æiß╗ćn li mß║Īnh thŲ░ß╗Øng gß║Ęp l├Ā:
+ C├Īc acid mß║Īnh: HCI, HNO3, H2SO4,ŌĆ”
+ C├Īc base mß║Īnh: NaOH, KOH, Ca(OH)2, Ba(OH)2,...
+ Hß║¦u hß║┐t c├Īc muß╗æi.
Qu├Ī tr├¼nh ph├ón li cß╗¦a chß║źt ─æiß╗ćn li mß║Īnh xß║Ży ra gß║¦n nhŲ░ ho├Ān to├Ān v├Ā ─æŲ░ß╗Żc biß╗āu diß╗ģn bß║▒ng m┼®i t├¬n mß╗Öt chiß╗üu.
HNO3 \(\to\) H+ + NO3ŌłÆ
NaOH \(\to\) Na+ + OHŌłÆ
Na2CO3 \(\to\) Na+ + CO32ŌłÆ
|
Chß║źt ─æiß╗ćn li yß║┐u l├Ā chß║źt khi tan trong nŲ░ß╗øc chß╗ē c├│ mß╗Öt phß║¦n sß╗æ ph├ón tß╗Ł chß║źt tan ph├ón li ra ion, phß║¦n c├▓n lß║Īi vß║½n tß╗ōn tß║Īi ß╗¤ dß║Īng ph├ón tß╗Ł trong dung dß╗ŗch. |
V├Ł dß╗ź: trong dung dß╗ŗch CH3COOH 0,1 M, cß╗Ł 1000 ph├ón tß╗Ł ho├Ā tan th├¼ chß╗ē c├│ 3 ph├ón tß╗Ł ph├ón li th├Ānh ion, c├▓n lß║Īi tß╗ōn tß║Īi ß╗¤ dß║Īng ph├ón tß╗Ł.
+ Nhß╗»ng chß║źt ─æiß╗ćn li yß║┐u gß╗ōm c├Īc acid yß║┐u nhŲ░ CH3COOH, HCIO, HF, H2CO3,... v├Ā base yß║┐u nhŲ░ Cu(OH)2, Fe(OH)2,ŌĆ”
+ Qu├Ī tr├¼nh ph├ón li cß╗¦a chß║źt ─æiß╗ćn li yß║┐u l├Ā mß╗Öt phß║Żn ß╗®ng thuß║Łn nghß╗ŗch v├Ā ─æŲ░ß╗Żc biß╗āu diß╗ģn bß║▒ng hai nß╗Ła m┼®i t├¬n ngŲ░ß╗Żc chiß╗üu nhau ( \(\rightleftharpoons\) )
CH3COOH \(\rightleftharpoons\) CH3COOŌłÆ + H+
|
PhŲ░ŲĪng tr├¼nh ion r├║t gß╗Źn - Trong dung dß╗ŗch, chß║źt ─æiß╗ćn li ph├ón li th├Ānh c├Īc ion v├Ā ch├Łnh c├Īc ion n├Āy trß╗▒c tiß║┐p tham gia v├Āo phß║Żn ß╗®ng ho├Ī hß╗Źc. Do vß║Ły, phŲ░ŲĪng tr├¼nh dß║Īng ion r├║t gß╗Źn ─æŲ░ß╗Żc sß╗Ł dß╗źng ─æß╗ā biß╗āu diß╗ģn c├Īc phß║Żn ß╗®ng xß║Ży ra giß╗»a c├Īc chß║źt ─æiß╗ćn li. - PhŲ░ŲĪng tr├¼nh ion r├║t gß╗Źn cho biß║┐t bß║Żn chß║źt cß╗¦a phß║Żn ß╗®ng trong dung dß╗ŗch c├Īc chß║źt ─æiß╗ćn li. |
V├Ł dß╗ź 1: Khi cho dung dß╗ŗch HCl (chß╗®a ion H+ v├Ā Cl-) t├Īc dß╗źng vß╗øi dung dß╗ŗch NaOH (chß╗®a ion Na+ v├Ā OH-), thß╗▒c tß║┐ chß╗ē xß║Ży ra phß║Żn ß╗®ng giß╗»a ion H+ v├Ā OH- theo phŲ░ŲĪng tr├¼nh ion r├║t gß╗Źn:
H++ OH- \(\to\) H2O
V├Ł dß╗ź 2: Khi cho dung dß╗ŗch BaCl2, t├Īc dß╗źng vß╗øi dung dß╗ŗch Na2SO4, thß╗▒c tß║┐ chß╗ē xß║Ży ra phß║Żn ß╗®ng giß╗»a ion Ba2+ v├Ā SO42-.
Theo phŲ░ŲĪng tr├¼nh ion r├║t gß╗Źn:
Ba2++SO42- \(\to\) BaSO4
1.2. Thuyß║┐t acidŌłÆbase cß╗¦a Br├Ėnsted ŌĆō Lowry
a. Kh├Īi niß╗ćm acid v├Ā base theo Br├Ėnsted ŌĆō Lowry
ŌłÆ N─ām 1923, nh├Ā ho├Ī hß╗Źc ngŲ░ß╗Øi ─Éan Mß║Īch J. Br├Ėnsted (BronŌĆō stß║┐t) v├Ā nh├Ā ho├Ī hß╗Źc ngŲ░ß╗Øi Anh T. Lowry (Lao-ri) ─æ├Ż ─æŲ░a ra mß╗Öt ─æß╗ŗnh ngh─®a tß╗Ģng qu├Īt hŲĪn vß╗ü acid, base.
|
Thuyß║┐t Br├Ėnsted ŌĆö Lowry cho rß║▒ng acid l├Ā chß║źt cho proton H+ v├Ā base l├Ā chß║źt nhß║Łn proton. |
V├Ł dß╗ź 1:
Trong phß║Żn ß╗®ng tr├¬n: HCl cho H+, HCl l├Ā acid; H2O nhß║Łn H+, H2O l├Ā base.
V├Ł dß╗ź 2:
Trong phß║Żn ß╗®ng thuß║Łn, NH3 nhß║Łn H+ cß╗¦a H2O, NH3 l├Ā base, H2O l├Ā acid. Trong phß║Żn ß╗®ng nghß╗ŗch, ion NH4+ l├Ā acid, OH- l├Ā base.
b. Ų»u ─æiß╗ām cß╗¦a thuyß║┐t acidŌłÆbase cß╗¦a Br├Ėnsted ŌĆō Lowry
ŌłÆ Theo thuyß║┐t Arrhenius
+ Trong ph├ón tß╗Ł acid phß║Żi c├│ nguy├¬n tß╗Ł H, trong nŲ░ß╗øc ph├ón li ra ion H+.
+ Trong ph├ón tß╗Ł base phß║Żi c├│ ph├ón tß╗Ł OH, trong nŲ░ß╗øc ph├ón li ra ion OH-.
ŌłÆ Thuyß║┐t Arrhenius chß╗ē ─æ├║ng trong dung m├┤i l├Ā nŲ░ß╗øc.
ŌłÆ Thuyß║┐t acidŌłÆbase cß╗¦a Br├Ėnsted ŌĆö Lowry tß╗Ģng qu├Īt hŲĪn thuyß║┐t Arrhenius, ph├ón tß╗Ł kh├┤ng c├│ nh├│m OH nhŲ░ NH3 hoß║Ęc ion CO32- vß║½n l├Ā base.
1.3. Kh├Īi niß╗ćm pH v├Ā ├Į ngh─®a cß╗¦a pH trong thß╗▒c tiß╗ģn
a. Kh├Īi niß╗ćm pH
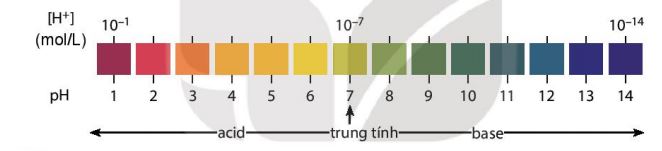
ŌłÆ Nß╗ōng ─æß╗Ö ion H+ hoß║Ęc ion OH- ─æŲ░ß╗Żc d├╣ng ─æß╗ā ─æ├Īnh gi├Ī t├Łnh acid hoß║Ęc t├Łnh base cß╗¦a c├Īc dung dß╗ŗch.
+ Tuy nhi├¬n, c├Īc dung dß╗ŗch c├│ nß╗ōng ─æß╗Ö H+, nß╗ōng ─æß╗Ö OH- thß║źp, ch├║ng l├Ā nhß╗»ng sß╗æ c├│ sß╗æ m┼® ├óm hoß║Ęc c├│ nhiß╗üu chß╗» sß╗æ thß║Łp ph├ón. V├¼ vß║Ły, ─æß╗ā tiß╗ćn sß╗Ł dß╗źng, ngŲ░ß╗Øi ta d├╣ng ─æß║Īi lŲ░ß╗Żng pH vß╗øi quy Ų░ß╗øc nhŲ░ sau:
|
pH = ŌĆō Lg[H+]hoß║Ęc [H+] = 10-pH |
+ Trong ─æ├│ [H+] l├Ā nß╗ōng ─æß╗Ö mol cß╗¦a ion H+.
+ Nß║┐u dung dß╗ŗch c├│ [H+] = 10-a mol/L th├¼ pH = a.
V├Ł dß╗ź: [H+] = 10-2 mol/L th├¼ pH = 2.
ŌłÆ M├┤i trŲ░ß╗Øng acid l├Ā m├┤i trŲ░ß╗Øng c├│ [H+] > [OH-] n├¬n [H+] > 10ŌłÆ7 mol/L hay pH < 7.
ŌłÆ M├┤i trŲ░ß╗Øng base l├Ā m├┤i trŲ░ß╗Øng c├│ [H+] < [OH-] n├¬n [H+] < 10-7 mol/L hay pH > 7.
ŌłÆ M├┤i trŲ░ß╗Øng trung t├Łnh l├Ā m├┤i trŲ░ß╗Øng c├│ [H+] = [OH ] = 10-7 mol/L hay pH = 7. Thang pH thŲ░ß╗Øng d├╣ng c├│ gi├Ī trß╗ŗ tß╗½ 1 ─æß║┐n 14.
b. ├Ø ngh─®a cß╗¦a pH trong thß╗▒c tiß╗ģn
Chß╗ē sß╗æ pH c├│ ├Į ngh─®a to lß╗øn trong thß╗▒c tiß╗ģn, pH c├│ li├¬n quan ─æß║┐n sß╗®c khoß║╗ cß╗¦a con ngŲ░ß╗Øi, sß╗▒ ph├Īt triß╗ān cß╗¦a ─æß╗Öng vß║Łt, thß╗▒c vß║Łt, ...
c. X├Īc ─æß╗ŗnh pH
- Gi├Ī trß╗ŗ pH cß╗¦a dung dß╗ŗch ─æŲ░ß╗Żc x├Īc ─æß╗ŗnh gß║¦n ─æ├║ng bß║▒ng c├Īch sß╗Ł dß╗źng chß║źt chß╗ē thß╗ŗ acid ŌĆō base.
- Khi cß║¦n x├Īc ─æß╗ŗnh gi├Ī trß╗ŗ pH ch├Łnh x├Īc hŲĪn, ngŲ░ß╗Øi ta sß╗Ł dß╗źng m├Īy ─æo pH.
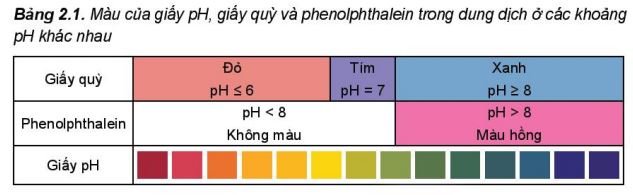
- Chß║źt chß╗ē thß╗ŗ acid ŌĆō base l├Ā chß║źt c├│ m├Āu sß║»c biß║┐n ─æß╗Ģi phß╗ź thuß╗Öc v├Āo gi├Ī trß╗ŗ pH cß╗¦a dung dß╗ŗch. Mß╗Öt sß╗æ chß║źt chß╗ē thß╗ŗ nhŲ░ giß║źy pH, giß║źy quß╗│, phenolphthalein c├│ m├Āu sß║»c thay ─æß╗Ģi trong c├Īc khoß║Żng pH kh├Īc nhau (Bß║Żng 2.1).
1.4. Sß╗▒ thuß╗Ę ph├ón cß╗¦a c├Īc ion
M├┤i trŲ░ß╗Øng cß╗¦a mß╗Öt sß╗æ dung dß╗ŗch muß╗æi
- Khi tan trong nŲ░ß╗øc, muß╗æi ph├ón li th├Ānh c├Īc ion. Phß║Żn ß╗®ng giß╗»a ion vß╗øi nŲ░ß╗øc tß║Īo ra c├Īc dung dß╗ŗch c├│ m├┤i trŲ░ß╗Øng kh├Īc nhau ─æŲ░ß╗Żc gß╗Źi l├Ā phß║Żn ß╗®ng thuß╗Ę ph├ón.
V├Ł dß╗ź: Trong dung dß╗ŗch Na2CO3, ion Na+ kh├┤ng bß╗ŗ thuß╗Ę ph├ón, c├▓n CO32- thuß╗Ę ph├ón trong nŲ░ß╗øc tß║Īo ion OH-.
CO32- + H2O \(\to\) HCO3- + OH-
ŌćÆ V├¼ vß║Ły, dung dß╗ŗch Na2CO3 c├│ m├┤i trŲ░ß╗Øng base.
1.5. Chuß║®n ─æß╗Ö acidŌłÆbase
Nguy├¬n tß║»c chuß║®n ─æß╗Ö acid base
|
- Chuß║®n ─æß╗Ö l├Ā phŲ░ŲĪng ph├Īp x├Īc ─æß╗ŗnh nß╗ōng ─æß╗Ö cß╗¦a mß╗Öt chß║źt bß║▒ng mß╗Öt dung dß╗ŗch chuß║®n ─æ├Ż biß║┐t nß╗ōng ─æß╗Ö. - Dß╗▒a v├Āo thß╗ā t├Łch cß╗¦a c├Īc dung dß╗ŗch khi phß║Żn ß╗®ng vß╗½a ─æß╗¦ vß╗øi nhau, x├Īc ─æß╗ŗnh ─æŲ░ß╗Żc nß╗ōng ─æß╗Ö dung dß╗ŗch chß║źt cß║¦n chuß║®n ─æß╗Ö. |
B├Āi tß║Łp minh hß╗Źa
B├Āi 1. Cho c├Īc chß║źt sau: NaCl; HF; CuSO4; NaOH; Mg(NO3)2; H3PO4; (NH4)3PO4; H2CO3; ethanol; CH3COOH; AgNO3; Glucose; glicerol; Al(OH)3; Fe(OH)2; HNO3.
X├Īc ─æß╗ŗnh chß║źt ─æiß╗ćn li mß║Īnh, chß║źt ─æiß╗ćn li yß║┐u, chß║źt kh├┤ng ─æiß╗ćn li? Viß║┐t phŲ░ŲĪng tr├¼nh ─æiß╗ćn li cß╗¦a c├Īc chß║źt (nß║┐u c├│).
HŲ░ß╗øng dß║½n giß║Żi:
- Chß║źt ─æiß╗ćn li mß║Īnh: NaCl; CuSO4; NaOH; Mg(NO3)2; (NH4)3PO4; AgNO3; HNO3.
+ PhŲ░ŲĪng tr├¼nh ─æiß╗ćn li:
NaCl \(\to\) Na+ + Cl-
CuSO4 \(\to\) Cu2+ + SO42-
NaOH \(\to\) Na+ + OH-
Mg(NO3)2 \(\to\) Mg2+ + 2NO3-
(NH4)3PO4 \(\to\) 3NH4+ + PO43-
AgNO3 \(\to\) Ag+ + NO3-
HNO3 \(\to\) H+ + NO3-
- Chß║źt ─æiß╗ćn li yß║┐u: HF; H3PO4; H2CO3; CH3COOH; Al(OH)3; Fe(OH)2.
+ PhŲ░ŲĪng tr├¼nh ─æiß╗ćn li:
HF \(\rightleftharpoons\) H+ + F-
CH3COOH \(\rightleftharpoons\) CH3COO- + H+
H3PO4 \(\rightleftharpoons\) H+ + H2PO4-
Al(OH)3 \(\rightleftharpoons\) Al3+ + 3OH-
H2PO4- \(\rightleftharpoons\) H+ + HPO42-
H2CO3 \(\rightleftharpoons\) H+ + HCO3-
HPO42- \(\rightleftharpoons\) H+ + PO43-
HCO3- \(\rightleftharpoons\) H+ + CO32-
Fe(OH)2 \(\rightleftharpoons\) Fe2+ + OH-
- Chß║źt kh├┤ng ─æiß╗ćn li: Glucose; glicerol; ethanol.
B├Āi 2. Tr├┤╠Żn 10g dung di╠Żch HCl 7,3% vŲĪ╠üi 20g dung di╠Żch H2SO4 4,9% r├┤╠Ći th├¬m nŲ░ŲĪ╠üc ─æ├¬╠ē ─æŲ░ŲĪ╠Żc 100ml dung di╠Żch A. Ti╠ünh pH cu╠ēa dung di╠Żch A.
HŲ░ß╗øng dß║½n giß║Żi:
- Sß╗æ mol HCl l├Ā nHCl = (10.7,3)/(100.36,5) = 0,02 mol
- Sß╗æ mol H2SO4 l├Ā nH2SO4 = (20.4,9)/(100.98) = 0,01 mol
- PhŲ░ŲĪng tr├¼nh ─æiß╗ćn li: HCl \(\to\) H+ + Cl-
0,02 \(\to\) 0,02 mol
H2SO4 \(\to\) 2H+ + SO42-
0,01 \(\to\) 0,02 mol
- Tß╗Ģng sß╗æ mol H+ l├Ā nH+ = 0,02 + 0,02 = 0,04 mol
CM(H+) = 0,04/0,1 = 0,4 M ŌćÆ pH = 0,4
Luyß╗ćn tß║Łp B├Āi 2 H├│a 11 Kß║┐t Nß╗æi Tri Thß╗®c
Hß╗Źc xong b├Āi hß╗Źc n├Āy, em c├│ thß╗ā:
ŌłÆ N├¬u ─æŲ░ß╗Żc kh├Īi niß╗ćm sß╗▒ ─æiß╗ćn li, chß║źt ─æiß╗ćn li, chß║źt kh├┤ng ─æiß╗ćn li, kh├Īi niß╗ćm v├Ā ├Į ngh─®a cß╗¦a pH trong thß╗▒c tiß╗ģn, nguy├¬n tß║»c x├Īc ─æß╗ŗnh nß╗ōng ─æß╗Ö acid, base mß║Īnh bß║▒ng phŲ░ŲĪng ph├Īp chuß║®n ─æß╗Ö.
ŌłÆ Viß║┐t ─æŲ░ß╗Żc biß╗āu thß╗®c t├Łnh pH v├Ā biß║┐t c├Īch sß╗Ł dß╗źng c├Īc chß║źt chß╗ē thß╗ŗ ─æß╗ā x├Īc ─æß╗ŗnh pH bß║▒ng c├Īc chß║źt chß╗ē thß╗ŗ phß╗Ģ biß║┐n nhŲ░ giß║źy chß╗ē thß╗ŗ m├Āu, quß╗│ t├Łm, phenolphthalein...
ŌłÆ Thß╗▒c hiß╗ćn ─æŲ░ß╗Żc th├Ł nghiß╗ćm chuß║®n ─æß╗Ö acid ŌĆō base: Chuß║®n ─æß╗Ö dung dß╗ŗch base mß║Īnh (sodium hydroxide) bß║▒ng acid mß║Īnh (hydrochloric acid).
ŌłÆ Tr├¼nh b├Āy ─æŲ░ß╗Żc ├Į ngh─®a thß╗▒c tiß╗ģn c├ón bß║▒ng trong dung dß╗ŗch nŲ░ß╗øc cß╗¦a ion Al3+, Fe3+ v├Ā CO, thuyß║┐t Br├Ėnsted ŌĆō Lowry vß╗ü acid ŌĆō base.
3.1. Trß║»c nghiß╗ćm B├Āi 2 H├│a 11 Kß║┐t Nß╗æi Tri Thß╗®c
C├Īc em c├│ thß╗ā hß╗ć thß╗æng lß║Īi nß╗Öi dung kiß║┐n thß╗®c ─æ├Ż hß╗Źc ─æŲ░ß╗Żc th├┤ng qua b├Āi kiß╗ām tra Trß║»c nghiß╗ćm H├│a hß╗Źc 11 KNTT B├Āi 2 cß╗▒c hay c├│ ─æ├Īp ├Īn v├Ā lß╗Øi giß║Żi chi tiß║┐t.
-
- A. HCl ŌåÆ H+ + Cl-
- B. CH3COOH \(\rightleftharpoons\) CH3COO- + H+
- C. H3PO4 ŌåÆ 3H+ + PO43-
- D. Na3PO4 ŌåÆ 3Na+ + PO43-
-
-
A.
H2SO4 \(\rightleftharpoons\) H+ + HSO4-
- B. H2CO3 \(\rightleftharpoons\) 2H+ + HCO3-
-
C.
H2SO3 ŌåÆ 2H+ + SO32-
- D. Na2S \(\rightleftharpoons\) 2Na+ + S2-
-
A.
-
Câu 3:
C├Īc chß║źt dß║½n ─æiß╗ćn l├Ā
- A. KCl n├│ng chß║Ży, dung dß╗ŗch NaOH, dung dß╗ŗch HNO3.
- B. dung dß╗ŗch glucose , dung dß╗ŗch alcohol ethylic , glycerine.
- C. KCl rß║»n khan, NaOH rß║»n khan, kim cŲ░ŲĪng.
- D. Kh├Ł HCl, kh├Ł NO, kh├Ł O3.
C├óu 4-10: Mß╗Øi c├Īc em ─æ─āng nhß║Łp xem tiß║┐p nß╗Öi dung v├Ā thi thß╗Ł Online ─æß╗ā cß╗¦ng cß╗æ kiß║┐n thß╗®c vß╗ü b├Āi hß╗Źc n├Āy nh├®!
3.2. B├Āi tß║Łp SGK B├Āi 2 H├│a 11 Kß║┐t Nß╗æi Tri Thß╗®c
C├Īc em c├│ thß╗ā xem th├¬m phß║¦n hŲ░ß╗øng dß║½n Giß║Żi b├Āi tß║Łp H├│a hß╗Źc 11 KNTT B├Āi 2 ─æß╗ā gi├║p c├Īc em nß║»m vß╗»ng b├Āi hß╗Źc v├Ā c├Īc phŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp.
Mß╗¤ ─æß║¦u trang 16 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Hoß║Īt ─æß╗Öng trang 16 SGK Ho├Ī hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Hoß║Īt ─æß╗Öng trang 17 SGK Ho├Ī hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Hoß║Īt ─æß╗Öng trang 18 Ho├Ī hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT:
Giß║Żi C├óu hß╗Åi 1 trang 18 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Hoß║Īt ─æß╗Öng trang 19 Ho├Ī hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi C├óu hß╗Åi 2 trang 20 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi C├óu hß╗Åi 3 trang 21 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c ŌĆō KNTT
Giß║Żi C├óu hß╗Åi 4 trang 21 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c ŌĆō KNTT
Giß║Żi C├óu hß╗Åi 5 trang 21 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi C├óu hß╗Åi 6 trang 22 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c ŌĆō KNTT
Giß║Żi C├óu hß╗Åi 7 trang 22 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Hoß║Īt ─æß╗Öng trang 23 Ho├Ī hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c ŌĆō KNTT
Hoß║Īt ─æß╗Öng trang 24 Ho├Ī hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c ŌĆō KNTT
Thß╗▒c h├Ānh trang 25 Ho├Ī hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c ŌĆō KNTT
Giß║Żi C├óu hß╗Åi 8 trang 26 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c ŌĆō KNTT
Giß║Żi C├óu hß╗Åi 9 trang 26 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Hß╗Åi ─æ├Īp B├Āi 2 H├│a 11 Kß║┐t Nß╗æi Tri Thß╗®c
Trong qu├Ī tr├¼nh hß╗Źc tß║Łp nß║┐u c├│ thß║»c mß║»c hay cß║¦n trß╗Ż gi├║p g├¼ th├¼ c├Īc em h├Ży comment ß╗¤ mß╗źc Hß╗Åi ─æ├Īp, Cß╗Öng ─æß╗ōng H├│a hß╗Źc HOC247 sß║Į hß╗Ś trß╗Ż cho c├Īc em mß╗Öt c├Īch nhanh ch├│ng!
Ch├║c c├Īc em hß╗Źc tß║Łp tß╗æt v├Ā lu├┤n ─æß║Īt th├Ānh t├Łch cao trong hß╗Źc tß║Łp!