DŲ░ß╗øi ─æ├óy l├Ā l├Į thuyß║┐t v├Ā b├Āi tß║Łp minh hß╗Źa B├Āi 1: Kh├Īi niß╗ćm vß╗ü c├ón bß║▒ng ho├Ī hß╗Źc m├┤n H├│a hß╗Źc lß╗øp 11 Kß║┐t Nß╗æi Tri Thß╗®c. B├Āi giß║Żng ─æ├Ż ─æŲ░ß╗Żc HOC247 bi├¬n soß║Īn ngß║»n gß╗Źn, ─æß║¦y ─æß╗¦, dß╗ģ hiß╗āu vß╗ü c├ón bß║▒ng ho├Ī hß╗Źc, c├Īc yß║┐u tß╗æ ß║Żnh hŲ░ß╗¤ng ─æß║┐n c├ón bß║▒ng ho├Ī hß╗Źc v├Ā nguy├¬n l├Ł chuyß╗ān dß╗ŗch c├ón bß║▒ng Le Chatelier gi├║p c├Īc em dß╗ģ d├Āng nß║»m ─æŲ░ß╗Żc nß╗Öi dung ch├Łnh cß╗¦a b├Āi.
T├│m tß║»t l├Į thuyß║┐t
1.1. Phß║Żn ß╗®ng mß╗Öt chiß╗üu v├Ā phß║Żn ß╗®ng thuß║Łn nghß╗ŗch
a. Phß║Żn ß╗®ng mß╗Öt chiß╗üu
ŌłÆ X├®t phß║Żn ß╗®ng ─æß╗æt ch├Īy kh├Ł methane trong kh├Ł oxygen:
CH4 + 2O2 \(\xrightarrow{{{t}^{o}}}\) CO2 + 2H2O
ŌłÆ Khi ─æß╗æt ch├Īy kh├Ł methane, thu ─æŲ░ß╗Żc sß║Żn phß║®m l├Ā khi carbon dioxide v├Ā hŲĪi nŲ░ß╗øc. Trong ─æiß╗üu kiß╗ćn n├Āy, c├Īc chß║źt sß║Żn phß║®m kh├┤ng phß║Żn ß╗®ng ─æŲ░ß╗Żc vß╗øi nhau ─æß╗ā tß║Īo th├Ānh chß║źt ─æß║¦u. Phß║Żn ß╗®ng nhŲ░ tr├¬n ─æŲ░ß╗Żc gß╗Źi l├Ā phß║Żn ß╗®ng mß╗Öt chiß╗üu.
ŌłÆ PhŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc cß╗¦a phß║Żn ß╗®ng mß╗Öt chiß╗üu ─æŲ░ß╗Żc biß╗āu diß╗ģn bß║▒ng mß╗Öt m┼®i t├¬n chß╗ē chiß╗üu phß║Żn ß╗®ng (\(\to\)).
V├Ł dß╗ź: NaOH + HCl \(\to\) NaCl + H2O.
b. Phß║Żn ß╗®ng thuß║Łn nghß╗ŗch
ŌłÆ X├®t phß║Żn ß╗®ng cß╗¦a kh├Ł hydrogen v├Ā iodine trong b├¼nh k├Łn ß╗¤ nhiß╗ćt ─æß╗Ö 4450C, c├│ hai phß║Żn ß╗®ng xß║Ży ra ─æß╗ōng thß╗Øi:
H2(g) + I2(g) \(\to\) 2HI(g)
2HI(g) \(\to\) H2(g) + I2(g)
ŌłÆ ß╗× th├Ł nghiß╗ćm tr├¬n, kh├Ł H2 t├Īc dß╗źng vß╗øi I2 tß║Īo th├Ānh HI, ─æß╗ōng thß╗Øi HI lß║Īi ph├ón huß╗Ę tß║Īo th├Ānh I2 v├Ā H2 n├¬n d├╣ thß╗Øi gian k├®o d├Āi bao l├óu, phß║Żn ß╗®ng vß║½n kh├┤ng thß╗ā xß║Ży ra ho├Ān to├Ān. Phß║Żn ß╗®ng giß╗»a H2 v├Ā I2, trong ─æiß╗üu kiß╗ćn tr├¬n ─æŲ░ß╗Żc gß╗Źi l├Ā phß║Żn ß╗®ng thuß║Łn nghß╗ŗch v├Ā ─æŲ░ß╗Żc biß╗āu diß╗ģn bß║▒ng phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc:
H2(g) + I2(g) \(\rightleftharpoons\) 2HI(g)
|
ŌłÆ Phß║Żn ß╗®ng thuß║Łn nghß╗ŗch l├Ā phß║Żn ß╗®ng xß║Ży ra theo hai chiß╗üu ngŲ░ß╗Żc nhau trong c├╣ng ─æiß╗üu kiß╗ćn. ŌłÆ PhŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc cß╗¦a phß║Żn ß╗®ng thuß║Łn nghß╗ŗch ─æŲ░ß╗Żc biß╗āu diß╗ģn bß║▒ng hai nß╗Ła m┼®i t├¬n ngŲ░ß╗Żc chiß╗üu nhau ( \(\rightleftharpoons\) ). Chiß╗üu tß╗½ tr├Īi sang phß║Żi l├Ā chiß╗üu phß║Żn ß╗®ng thuß║Łn, chiß╗üu tß╗½ phß║Żi sang tr├Īi l├Ā chiß╗üu phß║Żn ß╗®ng nghß╗ŗch. |
1.2. C├ón bß║▒ng ho├Ī hß╗Źc
a. Trß║Īng th├Īi c├ón bß║▒ng
ŌłÆ X├®t phß║Żn ß╗®ng thuß║Łn nghß╗ŗch:
H2(g) + I2(g) \(\rightleftharpoons\) 2HI(g)
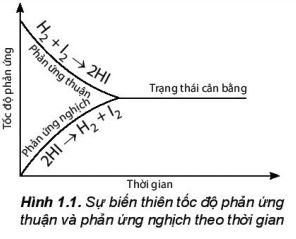
ŌłÆ L├║c ─æß║¦u phß║Żn ß╗®ng thuß║Łn c├│ tß╗æc ─æß╗Ö lß╗øn hŲĪn phß║Żn ß╗®ng nghß╗ŗch v├Ā Ų░u ti├¬n tß║Īo ra hydrogen iodide. Theo thß╗Øi gian, tß╗æc ─æß╗Ö phß║Żn ß╗®ng thuß║Łn giß║Żm dß║¦n, tß╗æc ─æß╗Ö phß║Żn ß╗®ng nghß╗ŗch t─āng dß║¦n ─æß║┐n khi tß╗æc ─æß╗Ö hai phß║Żn ß╗®ng bß║▒ng nhau (H├¼nh 1.1). Tß║Īi thß╗Øi ─æiß╗ām n├Āy, sß╗æ mol cß╗¦a c├Īc chß║źt hydrogen, iodine, hydrogen iodide kh├┤ng thay ─æß╗Ģi nß╗»a. ─É├óy l├Ā thß╗Øi ─æiß╗ām phß║Żn ß╗®ng thuß║Łn nghß╗ŗch ─æß║Īt tß╗øi trß║Īng th├Īi c├ón bß║▒ng.
|
ŌłÆ Trß║Īng th├Īi c├ón bß║▒ng cß╗¦a phß║Żn ß╗®ng thuß║Łn nghß╗ŗch l├Ā trß║Īng th├Īi tß║Īi ─æ├│ tß╗æc ─æß╗Ö phß║Żn ß╗®ng thuß║Łn bß║▒ng tß╗æc ─æß╗Ö phß║Żn ß╗®ng nghß╗ŗch. ŌłÆ C├ón bß║▒ng ho├Ī hß╗Źc l├Ā mß╗Öt c├ón bß║▒ng ─æß╗Öng, c├Īc chß║źt tham gia phß║Żn ß╗®ng li├¬n tß╗źc phß║Żn ß╗®ng vß╗øi nhau ─æß╗ā tß║Īo th├Ānh sß║Żn phß║®m v├Ā c├Īc chß║źt sß║Żn phß║®m c┼®ng li├¬n tß╗źc phß║Żn ß╗®ng vß╗øi nhau ─æß╗ā tß║Īo th├Ānh c├Īc chß║źt ─æß║¦u nhŲ░ng vß╗øi tß╗æc ─æß╗Ö bß║▒ng nhau n├¬n ß╗¤ trß║Īng th├Īi cß║¦n bß║▒ng, nß╗ōng ─æß╗Ö c├Īc chß║źt kh├┤ng thay ─æß╗Ģi. |
b. Hằng số cân bằng
Biß╗āu thß╗®c cß╗¦a hß║▒ng sß╗æ c├ón bß║▒ng
- X├®t phß║Żn ß╗®ng thuß║Łn nghß╗ŗch:
H2(g) + I2(g) \(\rightleftharpoons\) 2HI(g)
+ \({K_C} = \frac{{{\rm{ }}{{[{\rm{ }}HI]}^2}}}{{{\rm{ }}[{\rm{ }}{H_2}{\rm{ }}]{\rm{ }}[{\rm{ }}{I_2}{\rm{ }}]{\rm{ }}}}\) ─æŲ░ß╗Żc gß╗Źi l├Ā biß╗āu thß╗®c hß║▒ng sß╗æ c├ón bß║▒ng cß╗¦a phß║Żn ß╗®ng thuß║Łn nghß╗ŗch.
+ Dß║źu ngoß║Ęc vu├┤ng [A] biß╗āu thß╗ŗ nß╗ōng ─æß╗Ö chß║źt A ß╗¤ trß║Īng th├Īi c├ón bß║▒ng.
- X├®t phß║Żn ß╗®ng thuß║Łn nghß╗ŗch tß╗Ģng qu├Īt:
aA + bB \(\rightleftharpoons\) cC + dD
|
ß╗× trß║Īng th├Īi c├ón bß║▒ng, hß║▒ng sß╗æ c├ón bß║▒ng (Kc) cß╗¦a phß║Żn ß╗®ng ─æŲ░ß╗Żc x├Īc ─æß╗ŗnh theo biß╗āu thß╗®c: \({{K}_{C}}=\frac{\text{ }{{[\text{ C}]} ^{c}}\ {{\text{ }\!\![\!\!\text{ }\ D\ \text{ }\!\!]\!\!\text{ }}\ ^{d}}}{\text{ }{{[\text{ }A\text{ }]}^{a}}\text{ }[\text{ }B\text{ }]{{}^{b}}\text{ }}\) |
+ Trong ─æ├│: [A], [B], [C], [D] l├Ā nß╗ōng ─æß╗Ö mol cß╗¦a c├Īc chß║źt A, B, C, D ß╗¤ trß║Īng th├Īi c├ón bß║▒ng; a, b, c, d l├Ā hß╗ć sß╗æ tß╗ē lŲ░ß╗Żng cß╗¦a c├Īc chß║źt trong phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc cß╗¦a phß║Żn ß╗®ng.
+ Thß╗▒c nghiß╗ćm cho thß║źy: hß║▒ng sß╗æ c├ón bß║▒ng Kc cß╗¦a mß╗Öt phß║Żn ß╗®ng thuß║Łn nghß╗ŗch chß╗ē phß╗ź thuß╗Öc nhiß╗ćt ─æß╗Ö v├Ā bß║Żn chß║źt cß╗¦a phß║Żn ß╗®ng.
+ ─Éß╗æi vß╗øi c├Īc phß║Żn ß╗®ng c├│ chß║źt rß║»n tham gia, kh├┤ng biß╗āu diß╗ģn nß╗ōng ─æß╗Ö cß╗¦a chß║źt rß║»n trong biß╗āu thß╗®c hß║▒ng sß╗æ c├ón bß║▒ng.
V├Ł dß╗ź: C(s) + CO2(g) \(\rightleftharpoons\) 2CO(g) \({{K}_{C}}=\frac{\text{ }{{[CO]}^{2}}}{\text{ }[\text{ C}{{\text{O}}_{2}}]\text{ }}\)
├Ø ngh─®a cß╗¦a hß║▒ng sß╗æ c├ón bß║▒ng
- Hß║▒ng sß╗æ c├ón bß║▒ng Kc phß╗ź thuß╗Öc v├Āo bß║Żn chß║źt cß╗¦a phß║Żn ß╗®ng v├Ā nhiß╗ćt ─æß╗Ö.
- Biß╗āu thß╗®c x├Īc ─æß╗ŗnh hß║▒ng sß╗æ c├ón bß║▒ng \({{K}_{C}}=\frac{\text{ }{{[\text{ C}]} ^{c}}\ {{\text{ }\!\![\!\!\text{ }\ D\ \text{ }\!\!]\!\!\text{ }}\ ^{d}}}{\text{ }{{[\text{ }A\text{ }]}^{a}}\text{ }[\text{ }B\text{ }]{{}^{b}}\text{ }}\), cho thß║źy: Kc c├Āng lß╗øn th├¼ phß║Żn ß╗®ng thuß║Łn c├Āng chiß║┐m Ų░u thß║┐ hŲĪn v├Ā ngŲ░ß╗Żc lß║Īi, Kc c├Āng nhß╗Å th├¼ phß║Żn ß╗®ng nghß╗ŗch c├Āng chiß║┐m chiß║┐m Ų░u thß║┐ hŲĪn.
1.3. C├Īc yß║┐u tß╗æ ß║Żnh hŲ░ß╗¤ng ─æß║┐n sß╗▒ chuyß╗ān dß╗ŗch c├ón bß║▒ng ho├Ī hß╗Źc
a. ß║ónh hŲ░ß╗¤ng cß╗¦a nhiß╗ćt ─æß╗Ö
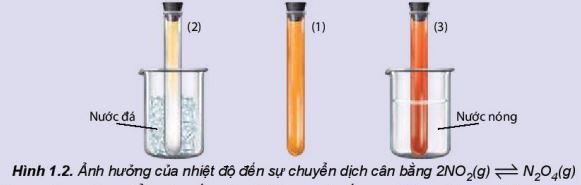
X├®t th├Ł nghiß╗ćm 1: 2NO2(g) \(\rightleftharpoons\) N2O4(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) < 0
Chuß║®n bß╗ŗ: 3 ß╗æng nghiß╗ćm chß╗®a kh├Ł NO2 (m├Āu n├óu ─æß╗Å), n├║t k├Łn c├│ m├Āu giß╗æng nhau, cß╗æc nŲ░ß╗øc ─æ├Ī, cß╗æc nŲ░ß╗øc n├│ng.
Tiß║┐n h├Ānh:
ŌĆō ß╗Éng nghiß╗ćm (1) ─æß╗ā so s├Īnh.
- Ng├óm ß╗æng nghiß╗ćm (2) v├Āo cß╗æc nŲ░ß╗øc ─æ├Ī trong khoß║Żng 1 ŌĆō 2 ph├║t.
ŌĆō Ng├óm ß╗æng nghiß╗ćm (3) v├Āo cß╗æc nŲ░ß╗øc n├│ng trong khoß║Żng 1 ŌĆō 2 ph├║t.
LŲ░u ├Į: NO2 l├Ā mß╗Öt kh├Ł ─æß╗Öc n├¬n phß║Żi ─æß║Ły k├Łn n├║t.
|
Khi t─āng nhiß╗ćt ─æß╗Ö, c├ón bß║▒ng chuyß╗ān dß╗ŗch theo chiß╗üu l├Ām giß║Żm nhiß╗ćt ─æß╗Ö, tß╗®c l├Ā chiß╗üu phß║Żn ß╗®ng thu nhiß╗ćt ( \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) > 0), ngh─®a l├Ā chiß╗üu l├Ām giß║Żm t├Īc ─æß╗Öng cß╗¦a viß╗ćc t─āng nhiß╗ćt ─æß╗Ö v├Ā ngŲ░ß╗Żc lß║Īi. |
b. ß║ónh hŲ░ß╗¤ng cß╗¦a nß╗ōng ─æß╗Ö
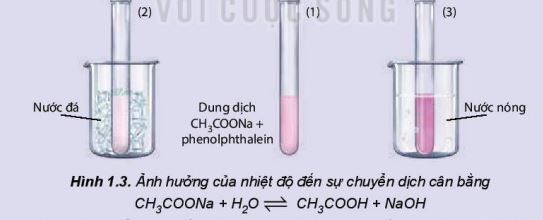
X├®t th├Ł nghiß╗ćm 2: CH3COONa + H2O \(\rightleftharpoons\) CH3COOH + NaOH \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) > 0
Chuß║®n bß╗ŗ: dung dß╗ŗch CH3COONa 0,5 M, phenophtalein; cß╗æc nŲ░ß╗øc n├│ng, cß╗æc nŲ░ß╗øc ─æ├Ī, 3 ß╗æng nghiß╗ćm.
Tiß║┐n h├Ānh:
- Cho khoß║Żng 10 mL dung dß╗ŗch CH3COONa 0,5 M v├Āo cß╗æc thuß╗Ę tinh, th├¬m 1 ŌĆō 2 giß╗Źt phenolphthalein, khuß║źy ─æß╗üu.
ŌĆō Chia dung dß╗ŗch thu ─æŲ░ß╗Żc v├Āo 3 ß╗æng nghiß╗ćm. ß╗Éng nghiß╗ćm (1) ─æß╗ā so s├Īnh, ß╗æng nghiß╗ćm (2) ng├óm v├Āo cß╗æc nŲ░ß╗øc ─æ├Ī, ß╗æng nghiß╗ćm (3) ng├óm v├Āo cß╗æc nŲ░ß╗øc n├│ng.
|
Khi t─āng nß╗ōng ─æß╗Ö mß╗Öt chß║źt trong phß║Żn ß╗®ng th├¼ c├ón bß║▒ng ho├Ī hß╗Źc bß╗ŗ ph├Ī vß╗Ī v├Ā chuyß╗ān dß╗ŗch theo chiß╗üu l├Ām giß║Żm nß╗ōng dß╗Ö cß╗¦a chß║źt ─æ├│ v├Ā ngŲ░ß╗Żc lß║Īi. |
c. ß║ónh hŲ░ß╗¤ng cß╗¦a ├Īp suß║źt
X├®t th├Ł nghiß╗ćm 3: 2NO2(g) \(\rightleftharpoons\) N2O4(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) < 0
Lß║źy mß╗Öt ß╗æng xi-lanh ─æß╗▒ng kh├Ł NO2. ─Éß║®y p├Łt-t├┤ng xuß╗æng ─æß╗ā l├Ām giß║Żm thß╗ā t├Łch v├Ā l├Ām t─āng ├Īp suß║źt trong ß╗æng. L├║c n├Āy, m├Āu cß╗¦a kh├Ł trong xi-lanh ─æß║Łm hŲĪn. Sau mß╗Öt thß╗Øi gian, kh├Ł trong ß╗æng lß║Īi nhß║Īt m├Āu hŲĪn (H├¼nh 1.5). NhŲ░ vß║Ły, khi t─āng ├Īp suß║źt, c├ón bß║▒ng tr├¬n chuyß╗ān dß╗ŗch theo chiß╗üu l├Ām giß║Żm sß╗æ mol kh├Ł trong xi-lanh.
|
Khi t─āng ├Īp suß║źt chung cß╗¦a hß╗ć th├¼ c├ón bß║▒ng sß║Į chuyß╗ān dß╗ŗch theo chiß╗üu l├Ām giß║Żm ├Īp suß║źt, tß╗®c l├Ā chiß╗üu l├Ām giß║Żm sß╗æ mol kh├Ł v├Ā ngŲ░ß╗Żc lß║Īi |
ŌłÆ ─Éß╗æi vß╗øi phß║Żn ß╗®ng thuß║Łn nghß╗ŗch c├│ tß╗Ģng hß╗ć sß╗æ tß╗ē lŲ░ß╗Żng cß╗¦a c├Īc chß║źt kh├Ł ß╗¤ hai vß║┐ phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc bß║▒ng nhau th├¼ trß║Īng th├Īi c├ón bß║▒ng cß╗¦a hß╗ć kh├┤ng bß╗ŗ chuyß╗ān dß╗ŗch khi thay ─æß╗Ģi ├Īp suß║źt chung cß╗¦a hß╗ć.
ŌłÆ ─Éß╗æi vß╗øi c├Īc phß║Żn ß╗®ng thuß║Łn nghß╗ŗch xß║Ży ra vß╗øi tß╗æc ─æß╗Ö chß║Łm th├¼ chß║źt x├║c t├Īc gi├║p hß╗ć phß║Żn ß╗®ng nhanh ─æß║Īt tß╗øi trß║Īng th├Īi c├ón bß║▒ng. Chß║źt x├║c t├Īc l├Ām t─āng tß╗æc ─æß╗Ö phß║Żn ß╗®ng thuß║Łn v├Ā phß║Żn ß╗®ng nghß╗ŗch vß╗øi sß╗æ lß║¦n bß║▒ng nhau n├¬n kh├┤ng l├Ām chuyß╗ān dß╗ŗch c├ón bß║▒ng.
d. Nguy├¬n l├Ł chuyß╗ān dß╗ŗch c├ón bß║▒ng Le Chatelier
ŌłÆ Qua viß╗ćc nghi├¬n cß╗®u c├Īc yß║┐u tß╗æ ß║Żnh hŲ░ß╗¤ng ─æß║┐n c├ón bß║▒ng, nh├Ā ho├Ī hß╗Źc ngŲ░ß╗Øi Ph├Īp Le Chatelier (LŲĪ Sa-tŲĪ-li-├¬) ─æ├Ż ─æŲ░a ra mß╗Öt nguy├¬n l├Ł mang t├¬n ├┤ng nhŲ░ sau:
|
Mß╗Öt phß║Żn ß╗®ng thuß║Łn nghß╗ŗch ─æang ß╗¤ trß║Īng th├Īi c├ón bß║▒ng, khi chß╗ŗu mß╗Öt t├Īc ─æß╗Öng b├¬n ngo├Āi l├Ām thay ─æß╗Ģi nß╗ōng ─æß╗Ö, nhiß╗ćt ─æß╗Ö, ├Īp suß║źt th├¼ c├ón bß║▒ng sß║Į chuyß╗ān dß╗ŗch theo chiß╗üu l├Ām giß║Żm t├Īc ─æß╗Öng b├¬n ngo├Āi ─æ├│. |
ŌłÆ Nguy├¬n l├Ł chuyß╗ān dß╗ŗch c├ón bß║▒ng Le Chatelier c├│ ├Į ngh─®a rß║źt lß╗øn khi ─æŲ░ß╗Żc vß║Łn dß╗źng v├Āo k─® thuß║Łt c├┤ng nghiß╗ćp ho├Ī hß╗Źc. NgŲ░ß╗Øi ta c├│ thß╗ā thay ─æß╗Ģi c├Īc ─æiß╗üu kiß╗ćn ─æß╗ā chuyß╗ān dß╗ŗch c├ón bß║▒ng theo chiß╗üu mong muß╗æn, l├Ām t─āng hiß╗ću suß║źt cß╗¦a phß║Żn ß╗®ng.
B├Āi tß║Łp minh hß╗Źa
X├®t c├ón bß║▒ng sau trong mß╗Öt b├¼nh k├Łn:
CaCO3(rß║»n) \(\rightleftharpoons\) CaO(rß║»n) + CO2(kh├Ł) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) = 178kJ.molŌłÆ1
ß╗× 820oC hß║▒ng sß╗æ c├ón bß║▒ng KC = 4,28.10-3.
a) Phß║Żn ß╗®ng tr├¬n l├Ā phß║Żn ß╗®ng tß╗Åa nhiß╗ćt hay thu nhiß╗ćt?
b) Khi phß║Żn ß╗®ng ─æang ß╗¤ trß║Īng th├Īi c├ón bß║▒ng, nß║┐u biß║┐n ─æß╗Ģi mß╗Öt trong nhß╗»ng ─æiß╗üu kiß╗ćn sau ─æ├óy th├¼ hß║▒ng sß╗æ c├ón bß║▒ng KC biß║┐n ─æß╗Ģi nhŲ░ thß║┐ n├Āo? Giß║Żi th├Łch.
- Giß║Żm nhiß╗ćt ─æß╗Ö cß╗¦a phß║Żn ß╗®ng xuß╗æng.
- Th├¬m khi CO2 v├Āo.
- T─āng dung t├Łch cß╗¦a b├¼nh phß║Żn ß╗®ng l├¬n.
- Lß║źy bß╗øt mß╗Öt lŲ░ß╗Żng CaCO3 ra.
HŲ░ß╗øng dß║½n giß║Żi
X├®t c├ón bß║▒ng sau trong mß╗Öt b├¼nh k├Łn:
CaCO3(rß║»n) \(\rightleftharpoons\) CaO(rß║»n) + CO2(kh├Ł) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) = 178kJ.molŌłÆ1
ß╗× 820oC hß║▒ng sß╗æ c├ón bß║▒ng KC = 4,28.10-3.
a) Phß║Żn ß╗®ng thu nhiß╗ćt v├¼ \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) = 178kJ.molŌłÆ1 > 0
b) KC = [CO2]
ŌłÆ Khi giß║Żm nhiß╗ćt ─æß╗Ö cß╗¦a phß║Żn ß╗®ng xuß╗æng th├¼ c├ón bß║▒ng sß║Į chuyß╗ān dß╗ŗch theo chiß╗üu nghß╗ŗch (chiß╗üu tß╗Åa nhiß╗ćt) ─æß╗ā ─æß║┐n trß║Īng th├Īi c├ón bß║▒ng mß╗øi v├Ā ß╗¤ trß║Īng th├Īi c├ón bß║▒ng mß╗øi n├Āy th├¼ nß╗ōng ─æß╗Ö CO2 giß║Żm ŌćÆ KC giß║Żm
- Khi th├¬m kh├Ł CO2 v├Āo ŌćÆ Nß╗ōng ─æß╗Ö CO2 t─āng ŌćÆ C├ón bß║▒ng chuyß╗ān dß╗ŗch theo chiß╗üu nghß╗ŗch nhŲ░ng ß╗¤ trß║Īng th├Īi c├ón bß║▒ng mß╗øi nß╗ōng ─æß╗Ö CO2 kh├┤ng thay ─æß╗Ģi KC kh├┤ng ─æß╗Ģi.
ŌłÆ Khi t─āng dung t├Łch cß╗¦a b├¼nh phß║Żn ß╗®ng l├¬n ŌćÆ ├üp suß║źt cß╗¦a hß╗ć giß║Żm (nß╗ōng ─æß╗Ö CO2 giß║Żm) ŌćÆ C├ón bß║▒ng chuyß╗ān dß╗ŗch theo chiß╗üu thuß║Łn l├Ām t─āng nß╗ōng ─æß╗Ö CO2 nhŲ░ng chß╗ē t─āng ─æß║┐n khi nß╗ōng ─æß╗Ö CO2 trŲ░ß╗øc khi dung t├Łch cß╗¦a b├¼nh l├¬n th├¼ dß╗½ng lß║Īi v├Ā c├ón bß║▒ng thiß║┐t lß║Łp ŌćÆ KC kh├┤ng ─æß╗Ģi.
ŌłÆ Lß║źy bß╗øt mß╗Öt lŲ░ß╗Żng CaCO3 ra th├¼ hß╗ć c├ón bß║▒ng kh├┤ng chuyß╗ān dß╗ŗch ŌćÆ KC kh├┤ng ─æß╗Ģi.
Luyß╗ćn tß║Łp B├Āi 1 H├│a 11 Kß║┐t Nß╗æi Tri Thß╗®c
Hß╗Źc xong b├Āi hß╗Źc n├Āy, em c├│ thß╗ā:
- Tr├¼nh b├Āy ─æŲ░ß╗Żc kh├Īi niß╗ćm phß║Żn ß╗®ng thuß║Łn nghß╗ŗch v├Ā trß║Īng th├Īi c├ón bß║▒ng cß╗¦a phß║Żn ß╗®ng thuß║Łn nghß╗ŗch.
- Viß║┐t ─æŲ░ß╗Żc biß╗āu thß╗®c hß║▒ng sß╗æ c├ón bß║▒ng (K) cß╗¦a phß║Żn ß╗®ng thuß║Łn nghß╗ŗch.
- Thß╗▒c hiß╗ćn ─æŲ░ß╗Żc th├Ł nghiß╗ćm nghi├¬n cß╗®u ß║Żnh hŲ░ß╗¤ng cß╗¦a nhiß╗ćt ─æß╗Ö tß╗øi chuyß╗ān dß╗ŗch c├ón bß║▒ng
- Vß║Łn dß╗źng ─æŲ░ß╗Żc nguy├¬n l├Ł chuyß╗ān dß╗ŗch c├ón bß║▒ng Le Chatelier ─æß╗ā giß║Żi th├Łch ß║Żnh hŲ░ß╗¤ng cß╗¦a nhiß╗ćt ─æß╗Ö, nß╗ōng ─æß╗Ö, ├Īp suß║źt ─æß║┐n c├ón bß║▒ng ho├Ī hß╗Źc.
3.1. Trß║»c nghiß╗ćm B├Āi 1 H├│a 11 Kß║┐t Nß╗æi Tri Thß╗®c
C├Īc em c├│ thß╗ā hß╗ć thß╗æng lß║Īi nß╗Öi dung kiß║┐n thß╗®c ─æ├Ż hß╗Źc ─æŲ░ß╗Żc th├┤ng qua b├Āi kiß╗ām tra Trß║»c nghiß╗ćm H├│a hß╗Źc 11 KNTT B├Āi 1 cß╗▒c hay c├│ ─æ├Īp ├Īn v├Ā lß╗Øi giß║Żi chi tiß║┐t.
-
- A. Phß║Żn ß╗®ng thuß║Łn ─æ├Ż kß║┐t th├║c
- B. Phß║Żn ß╗®ng nghß╗ŗch ─æ├Ż kß║┐t th├║c
- C. Tß╗æc ─æß╗Ö cß╗¦a phß║Żn ß╗®ng thuß║Łn v├Ā nghß╗ŗch bß║▒ng nhau.
- D. Nß╗ōng ─æß╗Ö cß╗¦a c├Īc chß║źt tham gia phß║Żn ß╗®ng v├Ā cß╗¦a c├Īc chß║źt sß║Żn phß║®m phß║Żn ß╗®ng bß║▒ng nhau
-
- A. Nß╗ōng ─æß╗Ö cß╗¦a N2 v├Ā H2.
- B. ├üp suß║źt chung cß╗¦a hß╗ć.
- C. Chß║źt x├║c t├Īc Fe.
- D. Nhiß╗ćt ─æß╗Ö cß╗¦a hß╗ć.
-
- A. C├ón bß║▒ng chuyß╗ān dß╗ŗch sang chiß╗üu thuß║Łn.
- B. C├ón bß║▒ng dß╗ŗch chuyß╗ān theo chiß╗üu nghß╗ŗch.
- C. C├ón bß║▒ng kh├┤ng thay ─æß╗Ģi.
- D. Phß║Żn ß╗®ng trß╗¤ th├Ānh mß╗Öt chiß╗üu.
C├óu 4-10: Mß╗Øi c├Īc em ─æ─āng nhß║Łp xem tiß║┐p nß╗Öi dung v├Ā thi thß╗Ł Online ─æß╗ā cß╗¦ng cß╗æ kiß║┐n thß╗®c vß╗ü b├Āi hß╗Źc n├Āy nh├®!
3.2. B├Āi tß║Łp SGK B├Āi 1 H├│a 11 Kß║┐t Nß╗æi Tri Thß╗®c
C├Īc em c├│ thß╗ā xem th├¬m phß║¦n hŲ░ß╗øng dß║½n Giß║Żi b├Āi tß║Łp H├│a hß╗Źc 11 KNTT B├Āi 1 ─æß╗ā gi├║p c├Īc em nß║»m vß╗»ng b├Āi hß╗Źc v├Ā c├Īc phŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp.
Mß╗¤ ─æß║¦u trang 6 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi C├óu hß╗Åi 1 trang 7 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi C├óu hß╗Åi 2 trang 8 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi C├óu hß╗Åi 3 trang 8 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Hoß║Īt ─æß╗Öng trang 6 SGK Ho├Ī hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Hoß║Īt ─æß╗Öng trang 8 SGK Ho├Ī hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi C├óu hß╗Åi 4 trang 9 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi C├óu hß╗Åi 5 trang 9 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Hoß║Īt ─æß╗Öng trang 9 SGK Ho├Ī hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi C├óu hß╗Åi 6 trang 10 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi C├óu hß╗Åi 7 trang 10 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Th├Ł nghiß╗ćm 1 trang 11 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Th├Ł nghiß╗ćm 2 trang 11 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Hoß║Īt ─æß╗Öng trang 12 SGK Ho├Ī hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi C├óu hß╗Åi 8 trang 13 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi C├óu hß╗Åi 9 trang 13 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi C├óu hß╗Åi 10 trang 14 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi C├óu hß╗Åi 11 trang 14 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi C├óu hß╗Åi 12 trang 15 SGK H├│a hß╗Źc 11 Kß║┐t nß╗æi tri thß╗®c - KNTT
Hß╗Åi ─æ├Īp B├Āi 1 H├│a 11 Kß║┐t Nß╗æi Tri Thß╗®c
Trong qu├Ī tr├¼nh hß╗Źc tß║Łp nß║┐u c├│ thß║»c mß║»c hay cß║¦n trß╗Ż gi├║p g├¼ th├¼ c├Īc em h├Ży comment ß╗¤ mß╗źc Hß╗Åi ─æ├Īp, Cß╗Öng ─æß╗ōng H├│a hß╗Źc HOC247 sß║Į hß╗Ś trß╗Ż cho c├Īc em mß╗Öt c├Īch nhanh ch├│ng!
Ch├║c c├Īc em hß╗Źc tß║Łp tß╗æt v├Ā lu├┤n ─æß║Īt th├Ānh t├Łch cao trong hß╗Źc tß║Łp!