Giải câu hỏi 3 trang 50 SGK Hóa học 10 Kết nối tri thức
Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử F2, CCl4 và NF3.
Hướng dẫn giải chi tiết bài 3
Hướng dẫn giải
Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm. Vì các khí hiếm ( trừ helium) đều có 8 electron lớp ngoài cùng nên quy tắc này được gọi là quy tắc octet.
Lời giải chi tiết
- Khi hình thành liên kết hóa học trong phân tử F2, nguyên tử fluorine có 7 electron hóa trị, mỗi nguyên tử fluorine cần thêm 1 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử fluorine góp chung một 1 electron. Phân tử F2 được biểu diễn

Xung quanh mỗi nguyên tử fluorine đều có 8 electron
- Khi hình thành liên kết hóa học trong phân tử CCl4, nguyên tử carbon có 4 electron hóa trị, nguyên tử carbon cần thêm 4 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử chlorine góp chung một 1 electron. Phân tử CCl4 được biểu diễn

Xung quanh mỗi nguyên tử carbon và chlorine đều có 8 electron
- Khi hình thành liên kết hóa học trong phân tử NF3, nguyên tử nitrogen có 5 electron hóa trị, nguyên tử nitrogen cần thêm 3 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử fluorine góp chung một 1 electron. Phân tử NF3 được biểu diễn
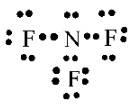
Xung quanh mỗi nguyên tử nitrogen và florine đều có 8 electron
-- Mod Hóa Học 10 HỌC247
-


Nguyên tố aluminium thuộc nhóm IIIA. Số electron hóa trị của nguyên tử nguyên tố aluminium là?
bởi Bình Nguyen
 24/10/2022
Theo dõi (0) 1 Trả lời
24/10/2022
Theo dõi (0) 1 Trả lời
Bài tập SGK khác
Giải câu hỏi 1 trang 49 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 2 trang 49 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 4 trang 50 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải bài 10.1 trang 28 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 10.2 trang 28 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 10.3 trang 28 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 10.4 trang 28 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 10.5 trang 28 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 10.6 trang 28 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 10.7 trang 28 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 10.8 trang 29 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 10.9 trang 29 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 10.10 trang 29 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 10.11 trang 29 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 10.12 trang 29 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 10.13 trang 29 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 10.14 trang 29 SBT Hóa học 10 Kết nối tri thức - KNTT





