Hướng dẫn Giải bài tập Hóa học 10 Chân trời sáng tạo Bài 11 Bài 11: Liên kết Hydrogen và tương tác Van der Waals môn Hóa học lớp 10 CTST giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức.
-
Giải câu hỏi 1 trang 67 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giữa liên kết S-H và liên kết O-H, liên kết nào phân cực mạnh hơn? Vì sao?
-
Giải câu hỏi 2 trang 68 SGK Hóa học 10 Chân trời sáng tạo - CTST
Quan sát các Hình 11.2 và 11.3, em hiểu thế nào là liên kết hydrogen giữa các phân tử?
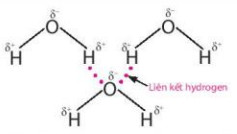
Hình 11.2. Liên kết hydrogen giữa các phân tử nước
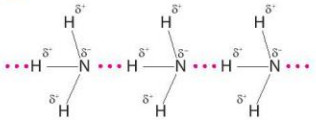
Hình 11.3. Liên kết hydrogen giữa các phần tử ammonia
-
Giải câu hỏi 3 trang 68 SGK Hóa học 10 Chân trời sáng tạo - CTST
So sánh độ bền của liên kết hydrogen với liên kết cộng hóa trị và liên kết ion?
-
Luyện tập trang 68 SGK Hóa học 10 Chân trời sáng tạo - CTST
Điều gì đã khiến H2O có nhiệt độ sôi cao hơn H2S? Giải thích?
-
Giải câu hỏi 4 trang 68 SGK Hóa học 10 Chân trời sáng tạo - CTST
So sánh nhiệt độ sôi và khả năng hòa tan trong nước giữa NH3 và CH4. Giải thích?
-
Giải câu hỏi 5 trang 69 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải thích vì sao một phân tử nước có thể tạo được liên kết hydrogen tối đa với bốn phân tử nước khác?
-
Vận dụng trang 69 SGK Hóa học 10 Chân trời sáng tạo - CTST
Vì sao nên tránh ướp lạnh các lon bia, nước giải khát,… trong ngăn đá của tủ lạnh?
-
Giải câu hỏi 6 trang 69 SGK Hóa học 10 Chân trời sáng tạo - CTST
Quan sát Hình 11.7, cho biết thế nào là một lưỡng cực tạm thời?
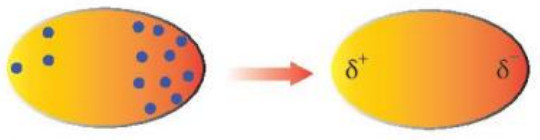
Hình 11.7. Lưỡng cực tạm thời được hình thành do sự phân bố không đồng đều của các electron trong phân tử
-
Giải câu hỏi 7 trang 70 SGK Hóa học 10 Chân trời sáng tạo - CTST
Các lưỡng cực tạm thời và lưỡng cực cảm ứng hút nhau bằng lực hút nào?
-
Giải câu hỏi 8 trang 70 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải thích xu hướng biến đổi bán kính nguyên tử, nhiệt độ nóng chảy và nhiệt độ sôi của các nguyên tố khí hiếm trong Bảng 11.1
Bảng 11.1. Nhiệt độ sôi và nhiệt độ nóng chảy của các khí hiếm
.jpg)
-
Vận dụng trang 70 SGK Hóa học 10 Chân trời sáng tạo - CTST
Tại sao nhện nước có thể di chuyển trên mặt nước?
-
Giải bài 1 trang 70 SGK Hóa học 10 Chân trời sáng tạo - CTST
Hợp chất nào dưới đây được liên kết hydrogen liên phân tử
A. CH4
B. H2O
C. PH3
D. H2S
-
Giải bài 2 trang 70 SGK Hóa học 10 Chân trời sáng tạo - CTST
Sự phân bố electron không đồng đều trong một nguyên tử hay một phân tử hình thành nên
A. một ion dương
B. một ion âm
C. một lưỡng cực vĩnh viễn
D. một lưỡng cực tạm thời
-
Giải bài 3 trang 70 SGK Hóa học 10 Chân trời sáng tạo - CTST
Khí hiếm nào dưới đây có nhiệt độ sôi thấp nhất?
A. Ne
B. Xe
C. Ar
D. Kr
-
Giải bài 4 trang 70 SGK Hóa học 10 Chân trời sáng tạo - CTST
Biểu diễn liên kết hydrogen giữa các phân tử:
a) Hydrogen fluoride
b) Ethanol (C2H5OH) và nước
-
Giải bài 5 trang 70 SGK Hóa học 10 Chân trời sáng tạo - CTST
Trong hai chất ammonia (NH3) và phosphine (PH3), theo em chất nào có nhiệt độ sôi và độ tan trong nước lớn hơn? Giải thích
-
Giải bài 11.1 trang 39 SBT Hóa học 10 Chân trời sáng tạo - CTST
Hợp chất nào sau đây tạo được liên kết hydrogen liên phân tử?
A. H2S.
B. PH3.
C. HI.
D. CH3OH.
-
Giải bài 11.2 trang 39 SBT Hóa học 10 Chân trời sáng tạo - CTST
Mặc dù chlorine có độ âm điện là 3,16 xấp xỉ với nitrogen là 3,04 nhưng giữa các phân tử HCl không tạo được liên kết hydrogen với nhau, trong khi giữa các phân tử NH3 tạo được liên kết hydrogen với nhau, nguyên nhân là do
A. độ âm điện của chlorine nhỏ hơn của nitrogen.
B. phân tử NH3 chứa nhiều nguyên tử hydrogen hơn phân tử HCl.
C. tổng số nguyên tử trong phân tử NH3 nhiều hơn so với phân tử HCl.
D. kích thước nguyên tử chlorine lớn hơn nguyên tử nitrogen nên mật độ điện tích âm trên chlorine không đủ lớn để hình thành liên kết hydrogen.
-
Giải bài 11.3 trang 39 SBT Hóa học 10 Chân trời sáng tạo - CTST
Sơ đồ nào sau đây thể hiện đúng liên kết hydrogen giữa 2 phân tử hydrogen fluoride (HF)?
A. \({H^{\delta + }} - {F^{\delta - }}...{H^{\delta + }} - {F^{\delta - }}\).
B. \({H^{\delta + }} - {F^{\delta + }}...{H^{\delta - }} - {F^{\delta - }}\).
C. \({H^{\delta - }} - {F^{\delta + }}...{H^{\delta - }} - {F^{\delta + }}\).
D. \({H^{\delta + }} - {F^{\delta - }}...{H^{\delta - }} - {F^{\delta + }}\).
-
Giải bài 11.4 trang 39 SBT Hóa học 10 Chân trời sáng tạo - CTST
Điều nào sau đây đúng khi nói về liên kết hydrogen liên phân tử?
A. Là lực hút tĩnh điện giữa nguyên tử H (thường trong các liên kết H-F, H-N, H-O ở phân tử này) với một trong các nguyên tử có độ âm điện mạnh (thường là N, O, F) ở một phân tử khác.
B. Là lực hút giữa các phân tử khác nhau.
C. Là lực hút tĩnh điện giữa các ion trái dấu.
D. Là lực hút giữa các nguyên tử trong một hợp chất cộng hoá trị.
-
Giải bài 11.5 trang 40 SBT Hóa học 10 Chân trời sáng tạo - CTST
Điều nào sau đây đúng khi nói về liên kết hydrogen nội phân tử?
A. Là lực hút giữa các proton của nguyên tử này với các electron ở nguyên tử khác.
B. Là lực hút tĩnh điện giữa nguyên tử H (thường trong các liên kết H-F, H-N, H-O) ở một phân tử với một trong các nguyên tử có độ âm điện mạnh (thường là N, O, F) ở ngay chính phân tử đó.
C. Là lực hút giữa các ion trái dấu.
D. Là lực hút giữa các phân tử có chứa nguyên tử hydrogen.
-
Giải bài 11.6 trang 40 SBT Hóa học 10 Chân trời sáng tạo - CTST
Tương tác van der Waals xuất hiện là do sự hình thành các lưỡng cực tạm thời cũng như các lưỡng cực cảm ứng. Các lưỡng cực tạm thời xuất hiện là do sự chuyển động của
A. các nguyên tử trong phân tử.
B. các electron trong phân tử.
C. các proton trong hạt nhân.
D. các neutron và proton trong hạt nhân
-
Giải bài 11.7 trang 40 SBT Hóa học 10 Chân trời sáng tạo - CTST
Trong các khí hiếm sau, khí hiếm có nhiệt độ sôi cao nhất là
A. Ne.
B. Xe.
C. Ar.
D. Kr.
-
Giải bài 11.8 trang 40 SBT Hóa học 10 Chân trời sáng tạo - CTST
Biểu diễn liên kết hydrogen giữa các phân tử sau:
a) methanol (CH3OH) và nước.
b) ethylene glycol (HOCH2CH2OH) và nước.
-
Giải bài 11.9 trang 40 SBT Hóa học 10 Chân trời sáng tạo - CTST
Ethylene glycol (HOCH2CH2OH) là một chất chống đông trong công nghiệp ô tô, hàng không do có khả năng can thiệp vào liên kết hydrogen của nước, làm các phân tử nước khó liên kết hơn, khiến nước khó đóng băng hơn. Biểu diễn liên kết hydrogen liên phân tử và nội phân tử trong ethylene glycol.
-
Giải bài 11.10 trang 40 SBT Hóa học 10 Chân trời sáng tạo - CTST
Hãy so sánh tương tác van der Waals với liên kết ion.
-
Giải bài 11.11 trang 40 SBT Hóa học 10 Chân trời sáng tạo - CTST
Thiết bị chụp cộng hưởng từ hạt nhân (NMR) sử dụng nitrogen lỏng để làm mắt nam châm siêu dẫn. Nitrogen lỏng sôi ở -195,8°C. Dự đoán nhiệt độ sôi của oxygen lỏng sẽ cao hay thấp hơn so với nitrogen lỏng? Giải thích.
-
Giải bài 11.12 trang 41 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải thích vì sao các tương tác van der Waals giữa các phân tử có kích thước lớn lại mạnh hơn so với các phân tử có kích thước nhỏ.
-
Giải bài 11.13 trang 41 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải thích tại sao ở điều kiện thường, các nguyên tố trong nhóm halogen như fluorine và chlorine ở trạng thái khí, còn bromine ở trạng thái lỏng và iodine ở trạng thái rắn.
-
Giải bài 11.14 trang 41 SBT Hóa học 10 Chân trời sáng tạo - CTST
Nhiệt độ sôi của các hợp chất với hydrogen của các nguyên tố nhóm VA, VIA và VIIA được biểu diễn qua đồ thị sau:
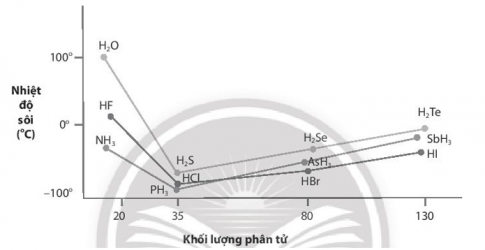
Nhiệt độ sôi của các hợp chất với hydrogen của các nguyên tố nhóm VA, VIA và VIIA
a. Giải thích nhiệt độ sôi cao bất thường của các hợp chất với hydrogen của các nguyên tố đầu tiên trong mỗi nhóm.
b. Nhận xét nhiệt độ sôi của các hợp chất với hydrogen của các nguyên tố còn lại ở mỗi nhóm và giải thích nguyên nhân sự biến đổi nhiệt độ sôi của chúng.
-
Giải bài 11.15 trang 41 SBT Hóa học 10 Chân trời sáng tạo - CTST
So sánh nhiệt độ nóng chảy và nhiệt độ sôi của pentane (CH3CH2CH2CH2CH3) và neopentane ((CH3)4C). Giải thích nguyên nhân sự khác biệt trên.
-
Giải bài 11.16 trang 41 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải thích vì sao tetrachloromethane (CCl4) tuy là phân tử không cực nhưng có nhiệt độ sôi cao hơn trichloromethane (CHCl3) là phân tử có cực.






