Ở bài học trước chúng ta đã tìm hiểu và biết cách tính nồng độ dung dịch. Nhưng làm thế nào để pha chế dung dịch theo nồng độ cho trước? Chúng ta cùng tìm hiểu nội dung bài học sau:
Tóm tắt lý thuyết
1.1. Cách pha chế dung dịch theo nồng độ cho trước
Đầu tiên ta xác định chất tan, dung môi là chất nào?
Có 2 kiểu pha chế:
- Pha chế dung dịch theo nồng độ phần trăm
- Pha chế dung dịch theo nồng độ mol
Bài tập 1: Từ muối CuSO4, nước cất và các dụng cụ cần thiết, hãy tính toán và nêu cách pha chế 50 gam dung dịch CuSO4 10%.
a) Tính toán
Đề bài cho khối lượng chất tan là 50 gam dung dịch CuSO4 và nồng độ phần trăm của dung dịch C% = 10%.
Vận dụng công thức tính khối lượng chất tan ta có:
\(m_{CuSO_{4}} = \frac{{C\% .{m_{dd}}}}{{100\% }}\) = \(\frac{{10\%.50 }}{{100\% }} = 5(gam)\)
Các em lưu ý tới công thức tính khối lượng dung dịch là mdung dịch = mdung môi + mchất tan
Có khối lượng chất tan (5gam CuSO4), có khối lượng dung dịch (50 gam). Như vậy ta suy ra được khối lượng dung môi (nước)
mdung dịch = mdung môi + mchất tan ⇒ mdung môi = mdung dịch - mchất tan = 50 - 5 = 45 (gam)
Vậy khối lượng nước cần dùng cho sự pha chế là 45 gam.
b) Cách pha chế:
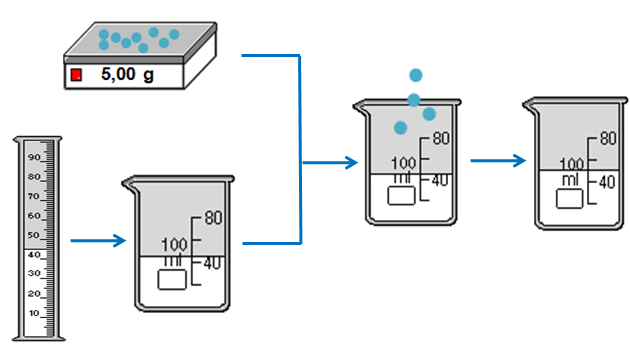
- Bước 1: Chuẩn bị
- Dụng cụ: Cân phân tích (cân có tính chính xác cao, tính theo mg), cốc chia độ, đũa thủy tinh, ống đong
- Hóa chất: CuSO4 rắn, khan, nước cất.
- Bước 2: Tiến hành pha chế
- Cân lấy 45 gam tinh thể CuSO4 (màu xanh)
- Dùng ống đong, đong 100ml nước cất rồi đổ vào cốc chia độ.
- Cho 5 gam CuSO4 vào cốc rồi khuấy đều bằng đũa thủy tinh ta được 50 gam dung dịch CuSO4 10%.
Hình 1: Quá trình pha chế 50 gam dung dịch CuSO4 10%
Bài tập 2: Từ muối CuSO4, nước cất và các dụng cụ cần thiết, hãy tính toán và nêu cách pha chế 50 ml dung dịch CuSO4 1M.
a) Tính toán
Từ công thức tính nồng độ mol của dung dịch nhận thấy có chứa 3 ẩn là số mol (n), thể tích (V) và nồng độ mol (CM).
Đề bài cung cấp 2 dữ kiện là thể tích dung dịch và nồng độ mol (1mol/l)
Vì đơn vị của nồng độ mol là mol/lít nên dữ kiện ml phải đổi về lít: 50 ml = \(\frac{{50}}{{1000}} = 0,05(lit)\)
Cho nguyên tử khối của Cu = 64, S = 32, O = 16
Cụ thể như sau:
Số mol CuSO4 chứa trong 50 ml dung dịch CuSO4 1M là:
\(n = {C_M}.V = 1.0,05 = 0,05(mol)\)
Khối lượng CuSO4 chứa trong 50 ml dung dịch CuSO4 1M là:
\({m_{CuS{O_4}}} = {n_{CuS{O_4}}}.{M_{CuS{O_4}}} = 0,05.(64 + 32 + 16.4) = 8(gam)\)
Vậy khối lượng CuSO4 cần thêm vào là 8 gam để tạo 50 ml dung dịch CuSO4 1M.
b) Cách pha chế
- Bước 1: Chuẩn bị
- Dụng cụ: Cân phân tích (cân có tính chính xác cao, tính theo mg), cốc chia độ, đũa thủy tinh, ống đong
- Hóa chất: CuSO4 rắn, khan, nước cất.
-
Bước 2: Tiến hành pha chế
- Cân 8g CuSO4 cho vào cốc thủy tinh dung tích 100ml.
- Đổ đần dần nước cất vào cốc và khuấy nhẹ cho đủ 50 ml dung dịch ta được 50 ml dung dịch CuSO4 1M.
Hình 2: Quá trình pha chế 50 ml dung dịch CuSO4 1M
1.2. Cách pha loãng dung dịch theo nồng độ cho trước
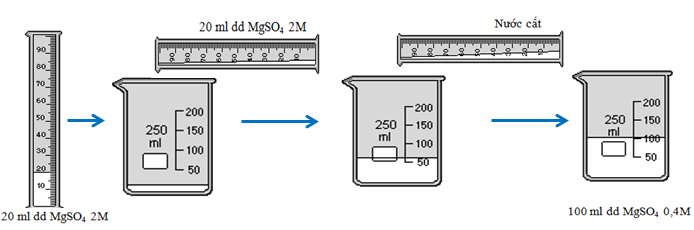
Bài tập 1: Từ muối MgSO4, nước cất và các dụng cụ cần thiết, hãy tính toán và nêu cách pha chế 100ml dung dịch MgSO4 0,4 M từ dung dịch MgSO4 2M.
a) Tính toán
Từ công thức tính nồng độ mol của dung dịch nhận thấy có chứa 3 ẩn là số mol (n), thể tích (V) và nồng độ mol (CM).
Đề bài cung cấp 2 dữ kiện là thể tích dung dịch (100 ml) và nồng độ mol (0,4M)
Lưu ý: Vì đơn vị của nồng độ mol là (mol/lit) nên thể tích phải đổi từ ml sang lít.
Cho nguyên tử khối của Mg = 24, S = 32, O = 16
Cụ thể như sau:
Đổi 100ml thành 0,1 lít
Số mol chất tan có trong 100ml dung dịch 0,4M:
\({n_{MgS{O_4}}} = {C_M}.V = 0,4.0,1 = 0,04(mol)\)
+ Thể tích dung dịch MgSO4 2M trong đó có 0,04 mol MgSO4:
\(V' = \frac{n}{{{C_M}'}} = \frac{{0,04}}{2} = 0,02(lit)=20(ml)\)
b) Cách pha chế
- Bước 1: Chuẩn bị
- Dụng cụ: Cốc chia độ, đũa thủy tinh, ống đong
- Hóa chất: dung dịch MgSO4 2M, nước cất
- Bước 2: Tiến hành pha chế
- Lấy 20ml dung dịch MgSO4 cho vào cốc thủy tinh 250ml
- Đổ từ từ nước cất vào cốc và khuấy nhẹ đến 100ml thì dừng lại ta được 100ml dung dịch MgSO4 0,04M.
Hình 3: Quá trình pha loãng dung dịch MgSO4 2M
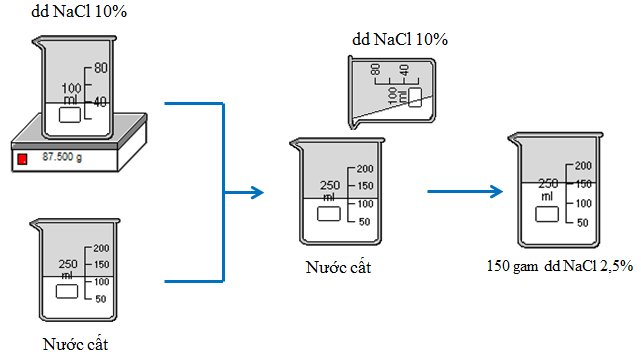
Bài tập 2: Từ muối NaCl, nước cất và các dụng cụ cần thiết, hãy tính toán và nêu cách pha chế 150g dung dịch NaCl 2,5% từ dung dịch NaCl 10%.
a) Tính toán
Khối lượng NaCl trong 150g dung dịch NaCl 2,5% là:
\({m_{NaCl}} = \frac{{C\% .{m_{{\rm{dd}}}}}}{{{\rm{100\% }}}} = \frac{{2,5.150}}{{100}} = 3,75(g)\)
Khối lượng dung dịch NaCl ban đầu chứa 3,75g NaCl là:
\({m_{{\rm{dd}}}} = \frac{{{m_{ct}}.100\% }}{{C\% }} = \frac{{3,75.100}}{{10}} = 37,5(g)\)
Khối lượng nước cần dùng là:
mdm= 150 – 37,5 = 112,5(g)
b) Cách pha chế
- Bước 1: Chuẩn bị
- Dụng cụ: Cân phân tích (cân có tính chính xác cao, tính theo mg), cốc chia độ hoặc bình tam giác, đũa thủy tinh, ống đong
- Hóa chất: muối NaCl, nước cất
- Bước 2: Tiến hành pha chế
- Cân lấy 37,5g dung dịch NaCl 10% cho vào cốc thủy tinh 200ml (hoặc bình tam giác.
- Đong lấy 112,5ml nước cất rồi đổ từ từ vào cốc đựng dung dịch NaCl 10%, khuấy đều. Ta được dung dịch NaCl 2,5%.
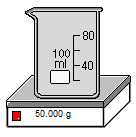
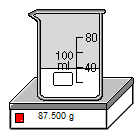
Lưu ý: Khi cân dung dịch ta cân cả dung dịch và bình chứa dung dịch nên ta sẽ cân riêng bình đựng, sau đó lấy tổng khối lượng trừ đi khối lượng bình là ra được khối lượng dung dịch chứa trong bình. Cụ thể như bài này. Khối lượng bình rỗng là 50 gam, tổng khối lượng bình và dung dịch là 87,8 gam. Như vậy ta vừa cân được 87,5 - 50 = 37,5 gam dung dịch.
Hình 4: Đầu tiên ta cân bình rỗng
Hình 5: Sau đó, cân cả khối lượng của bình và dung dịch
Hình 6: Quá trình pha chế dung dịch NaCl 2,5%
2. Luyện tập Bài 43 Hóa học 8
Sau bài học cần nắm:
- Cách pha chế dung dịch theo nồng độ cho trước
- Cách pha loãng dung dịch theo nồng độ cho trước
2.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 8 Bài 43 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. 52,65g
- B. 54,65g
- C. 60,12g
- D. 60,18g
-
- A. 14 gam
- B. 15 gam
- C. 16 gam
- D. 17 gam
-
Câu 3:
Có 60g dung dịch NaOH 20%. Khối lượng NaOH cần cho thêm vào dung dịch trên để được dung dịch 25% là:
- A. 4 gam
- B. 5 gam
- C. 6 gam
- D. 7 gam
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
2.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 8 Bài 43.
Bài tập 1 trang 149 SGK Hóa học 8
Bài tập 2 trang 149 SGK Hóa học 8
Bài tập 3 trang 149 SGK Hóa học 8
Bài tập 4 trang 149 SGK Hóa học 8
Bài tập 5 trang 149 SGK Hóa học 8
Bài tập 43.1 trang 59 SBT Hóa học 8
Bài tập 43.2 trang 59 SBT Hóa học 8
Bài tập 43.3 trang 59 SBT Hóa học 8
Bài tập 43.4 trang 59 SBT Hóa học 8
Bài tập 43.5 trang 59 SBT Hóa học 8
Bài tập 43.6 trang 59 SBT Hóa học 8
Bài tập 43.7 trang 59 SBT Hóa học 8
Bài tập 43.8 trang 60 SBT Hóa học 8
Bài tập 43.9 trang 60 SBT Hóa học 8
3. Hỏi đáp về Bài 43 Chương 6 Hóa học 8
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.


.PNG)