HOC247 xin giới thiệu đến quý thầy cô và các em học sinh Các dạng bài toán liên quan đến Chương 2 môn Hóa học 11 năm 2019-2020, với nội dung chi tiết có đáp án đi kèm sẽ giúp các em ôn tập kiến thức, rèn luyện kỹ năng giải đề đồng thời tự đánh giá được năng lực bản thân từ đó có kế hoạch ôn tập cụ thể. Hy vọng đây sẽ là tài liệu hữu ích giúp các em đạt điểm số thật cao trong kỳ thi sắp tới!
CÁC DẠNG BÀI TOÁN LIÊN QUAN CHƯƠNG 2 MÔN HÓA HỌC 11 NĂM 2019-2020
I. Dạng bài toán hiệu suất
Công thức thường dùng:
\(\frac{{{n_1}}}{{{n_2}}} = \frac{{{P_1}}}{{{P_2}}} = \frac{{{M_2}}}{{{M_1}}}\) (khi đề bài không cho số mol thì xem tỉ lệ mol như là mol)
n1, n2: tổng số mol hỗn hợp ban đầu và sau phản ứng.
P1, P2: áp suất hỗn hợp ban đầu và sau phản ứng.
M1, M2: khối lượng trung bình hỗn hợp ban đầu và sau phản ứng.
Câu 1: Hỗn hợp A gồm N2 và H2 theo tỉ lệ 1 : 3 về thể tích. Tạo điều kiện cho phản ứng xảy ra. Tỉ khối của A đối với hỗn hợp B sau phản ứng là 0,6. Hiệu suất của phản ứng là
A. 80% B. 50% C. 70% D. 85%
Câu 2: Để điều chế 4 lít NH3 từ N2 và H2 với hiệu suất 50% thì thể tích H2 cần dùng ở cùng điều kiện là bao nhiêu? A. 4 lít B. 6 lít C. 8 lít D. 12 lít
Câu 3: Cho vào bình kín thể tích không đổi 0,2 mol NO và 0,3 mol O2, áp suất trong bình là P1. Sau khi phản ứng hoàn toàn đưa bình về nhiệt độ ban đầu thì áp suất là P2. Tỉ lệ của P1 và P2 là
A. P1 = 1,25P2 B. P1 = 0,8P2 C. P1 = 2P2 D. P1 = P2
Câu 4: Cho 4 lít N2 và 14 lít H2 vào bình phản ứng, hỗn hợp thu được sau phản ứng có thể tích bằng 16,4 lít (thể tích các khí được đo ở cùng điều kiện). Hiệu suất phản ứng là
A. 50% B. 30% C. 20% D. 40%
Câu 5: Hỗn hợp khí X gồm N2 và H2 có tỉ khối so với He bằng 1,8. Đun nóng X một thời gian trong bình kín (có bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối so với He bằng 2. Hiệu suất của phản ứng tổng hợp NH3 là
A. 50%. B. 36%. C. 40%. D. 25%.
Câu 6: Trong một bình kín chứa 10 lít nitơ và 10 lít hiđro ở nhiệt độ 00C và 10 atm. Sau phản ứng tổng hợp NH3, lại đưa bình về 00C. Nếu áp suất trong bình sau phản ứng là 9atm thì phần trăm các khí tham gia phản ứng là
A. N2 : 20% , H2 : 40% B. N2 : 30% , H2 : 20%
C. N2 : 10% , H2 : 30% D. N2 : 20% , H2 : 20%.
Câu 7: Trong một bình kín chứa 10 lít nitơ và 10 lít hiđro ở nhiệt độ 0oC và 10 atm. Sau phản ứng tổng hợp NH3, lại đưa bình về nhiệt độ ban đầu. Biết rằng có 60% hiđro tham gia phản ứng, áp suất trong bình sau phản ứng là
A. 10 atm B. 8 atm C. 9 atm D. 8,5 atm
Câu 8: Một hỗn hợp gồm 8 mol N2 và 14 mol H2 được nạp vào một bình kín có dung tích 4 lít và giữ ở nhiệt độ không đổi. Khi phản ứng đạt trạng thái cân bằng thì áp suất bằng 10/11 áp suất ban đầu. Hiệu suất phản ứng là
A. 17,18% B. 18,18% C. 36,36% D. 34,36%
Câu 9: Cho hỗn hợp khí N2, H2 và NH3 có tỉ khối so với H2 là 8. Dẫn hỗn hợp đi qua H2SO4 đặc dư thì thể tích khí còn lại một nửa. Thành phần phần % theo thể tích của mỗi khí trong hỗn hợp lần lượt là
A. 25% H2, 25% N2, 50% NH3 B. 25% H2, 50% N2, 25% NH3
C. 50% H2, 25% N2, 25% NH3 , D. 30%N2, 20%H2, 50% NH3
Câu 10: Cho hỗn hợp N2 và H2 vào bình phản ứng có nhiệt độ không đổi. Sau thời gian phản ứng, áp suất khí trong bình giảm 5% so với áp suất ban đầu. Biết ti lệ số mol của nitơ đã phản ứng là 10%. Thành phần phần trăm về số mol của N2 và H2 trong hỗn hợp đầu là:
A. 15% và 85% B. 82,35% và 77,5%
C. 25% và 75% D. 22,5% và 77,5%.
Câu 11: Cho 5 lít N2 và 15 lít H2 vào một bình kính dung tích không đổi. Ở 0oC, áp suất trong bình là P1 atm. Đun nóng bình một thời gian thì thấy có 20% N2 tham gia phản ứng, đưa bình về nhiệt độ ban đầu thấy áp suất trong bình lúc này là P2. Tỉ lệ P1 và P2 là
A. 6 : 10 B. 10 : 6 C. 10 : 9 D. 9 : 10
II. Dạng bài toán H3PO4 hoặc P2O5 tác dụng với NaOH, Ca(OH)2
- Xét tỉ lệ mol \(T = \frac{{{n_{O{H^ - }}}}}{{{n_{{H_3}P{O_4}}}}}\) (tối đa chỉ tạo được 2 muối cùng lúc)
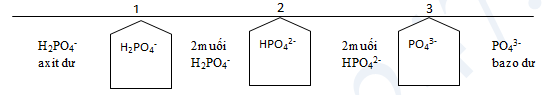
- Gọi số mol mỗi muối là x, y.
- Bảo toàn nguyên tố P, Na, Ca…và bảo toàn điện tích Ca2+, Na+ và H2PO4-, HPO42-, PO43- để lập hệ phương trình theo x, y.
Câu 1: Để trung hoà 100ml H3PO4 1M cần bao nhiêu mililit NaOH 1M?
A. 100ml B. 200ml C. 300ml D. 150ml.
Câu 2: Khối lượng H2SO4 65% để điều chế 527,35kg supephotphat kép
A. 677kg B. 700kg C. 650kg D. 720kg
Câu 3: Trộn dung dịch có 11,76 gam H3PO4 vào dung dịch có 16,8g KOH. Khối lượng các muối thu được là
A. 10,44g KH2PO4; 8,5g K3PO4 B. 10,24g K2HPO4; 13,5g K3PO4
C. 10,44g K2HPO4; 12,72g K3PO4 D. 10,20g KH2PO4; 13,5g K2HPO4; 8,5g K3PO4
Câu 4: Cho 14,2g P2O5 tan trong 400g dung dịch NaOH 5% thì sau phản ứng thu được
A. Na2HPO4, Na3PO4 B. NaH2PO4, Na2HPO4
C. NaH2PO4, Na2HPO4 D. NaH2PO4 , Na2HPO4, Na3PO4
Câu 5: Cho 12g dung dịch NaOH 10% tác dụng với 5,88g dung dịch H3PO4 20% thu được dung dịch X. Trong X chứa các muối
A. Na3PO4 B. NaH2PO4 và Na2HPO4
C. NaH2PO4 D. NaHPO4 và Na3PO4
Câu 6: Thêm 6 gam P2O5 vào 25 ml dung dịch H3PO4 6%, d = 1,03g/ml. Nồng độ của H3PO4 thu được là
A. 32,94% B. 30,94% C. 31,94% D. 39,40%
Câu 7: Hòa tan hỗn hợp gồm 8,49gam P và S vào lượng HNO3 vừa đủ thu được dung dịch X và sản phẩm khử duy nhất là NO2. Để trung hòa hoàn toàn X thì cần vừa đủ 0,69 mol NaOH. Số mol NO2 thu được là
A. 1,36 mol B. 1,48 mol C. 1,47 mol D. 1,35 mol
Câu 8: Đốt 7,75 gam photpho trong oxi dư rồi hấp thụ toàn bộ sản phẩm vào bình đựng 100 gam NaOH 25%. Nồng độ phần trăm các chất trong dung dịch thu được sau phản ứng là
A. 15,07 % NaH2PO4 ; 17,4% Na3PO4
B. 17,75 % NaH2PO4 ; 20,5% Na3PO4
C. 15,07 % Na2HPO4 ; 17,4% Na3PO4
D. 17,75 % Na2HPO4 ; 20,5% Na3PO4
Câu 9: Đốt cháy hoàn toàn m gam photpho trong oxi thu được chất rắn X, hòa tan X bằng dung dịch chứa 0,28 mol NaOH thì được 17,92 gam hỗn hợp hai muối photphat (trong đó có một muối trug hòa). Giá trị của m là
A. 8,68 B. 4,96 C. 3,41 D. 3,72
Câu 10: Hòa tan hỗn hợp gồm 1,73gam P và S vào lượng dung dịch 0,35mol HNO3 vừa đủ thu được dung dịch X và sản phẩm khử duy nhất là NO2.Trung hòa hoàn toàn X thì cần vừa đủ 0,19 mol NaOH. Phần trăm khối lượng P trong hỗn hợp ban đầu là:
A. 46,24% B. 62,15% C. 52,45% D. 53,76%
III. Dạng bài toán về axit HNO3
- Để tìm công thức của FexOy ta nên quy thành hỗn hợp x mol Feo và y mol Oo rồi tìm tỉ lệ x : y
Feo – 3e → Fe3+
Oo + 2e → O2-
xN+5 + (5x-2y).e → NxOy và lập hệ phương trình mFe + mO = mFexOy và ne cho = ne nhận
- Kim loại dư hoặc HNO3 tối thiểu thì Fe chỉ tăng lên Fe2+.
Feo – 2e → Fe2+
- Khi oxi hóa hỗn hợp kim loại thành oxit thì mO = mtăng và nO nguyên tử
- Hỗn hợp Fe và FeO, Fe2O3, Fe3O4 nên quy đổi thành hỗn hợp của Feo và Oo (hoặc FeS, CuS2, FeS2…thì quy đổi thành Feo, Cuo và So). Do đó, khi cho hỗn hợp trên tác dụng với HNO3 ta được:
Feo – 3e → Fe3+
Cuo – 2e → Cu2+
So – 6e → S6+ hoặc So – 4e → S4+
Oo + 2e → O2-
xN+5 + (5x-2y).e → NxOy
- Khi cho Al, Zn, Mg tác dụng với HNO3 loãng thường sinh ra NH4NO3. Số mol NH4NO3 tính bằng độ chênh lệch electron chia 8: n NH4NO3 =
- Cho hỗn hợp gồm Fe và kim loại A, B có hóa trị không đổi lần lượt tác dụng với HCl/H2SO4 loãng và
HNO3 hoặc H2SO4 đặc, ta sẽ có ne(2) > ne(1) và nFe = ne(2) - ne(1)
- Hỗn hợp của H+ (HCl/H2SO4 loãng) với NO3- (muối nitrat hoặc HNO3) tác dụng với kim loại Fe, Cu...thì phương trình phản ứng là:
3Cu + 2NO3- + 8H+ → 3Cu2+ + 2NO + 4H2O
Fe + NO3- + 4H+ → Fe3+ + NO + 2H2O
Hoặc 3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO + 2H2O
Dạng 1. Các bài tập vận dụng các định luật bảo toàn dạng cơ bản
Câu 1: Cho 21,6g một kim loại tác dụng hết với dung dịch HNO3 thu được 6,72 lit N2O (đktc). Kim loại đó là
A. Na B. Zn C. Mg D. Al
Câu 2: Hoà tan 13,92g Fe3O4 bằng HNO3 thu được 448 ml NxOy (đktc). Khí NxOy có công thức là
A. NO B. NO2 C. N2O D. N2O3
Câu 3: Cho m (g) Cu tác dụng HNO3 dư được 8,96 lít (đktc) hỗn hợp NO và NO2 có khối lượng là 15,2 gam. Giá trị của m là
A. 25,6 B. 16 C. 2,56 D. 8
Câu 4: Hoà tan hoàn toàn 11,68g Cu và CuO trong 2 lit dung dịch HNO3 0,25M thu được 1,752 lit khí NO (đktc). Phần trăm khối lượng CuO trong hỗm hợp ban đầu là
A. 61,64% B. 34,20% C. 39,36% D. 65,80%
Câu 5: Cho m gam Fe tác dụng với HNO3 thu được 6,72 lit hỗn hợp NO, NO2 có tỉ khối so với H2 là 19 và dd A chứa Fe(NO3)3 và 10,8 g Fe(NO3)2. Giá trị m là
A. 5,6 B. 16,8 C. 12,32 D. 11,2
Câu 6: Cho 1,35 gam hỗn hợp Cu, Mg, Al tác dụng hết với HNO3 thu được 0,01 mol NO và 0,04 mol NO2. Khối lượng muối tạo thành là
A. 5,6g B. 4,45g C. 5,07g D. 2,485g.
Câu 7: Hoà tan 1,2 gam kim loại M vào HNO3 thu được 0,224 lit N2 (đktc) (sản phẩm khử duy nhất). Kim loại M là
A. Ca B. Fe C. Mg D. Al
Câu 8: Hoà tan Zn và ZnO vào HNO3 loãng dư. Kết thúc thí nghiệm thu được 8g NH4NO3 (không có khí thoát ra) và 113,4 gam Zn(NO3)2. Phần trăm số mol của Zn trong hỗn hợp là
A. 66,67% B. 33,33% C. 16,66% D. 93,34%
Câu 9: Cho 11gam gồm Al, Fe vào HNO3 loãng dư thu được 6,72 lít NO (duy nhất). Khối lượng của Al và Fe trong hỗn hợp lần lượt là
A. 5,4g; 5,6g B. 5,6g; 5,4g C. 8,1g; 2,9g D. 2,1g; 8,9g
Câu 10: Cho 8,2g hỗn hợp Al và Fe có tỉ lệ mol là 4 : 1 hoà tan hoàn toàn vào dung dịch HNO3 thu được 5,6 lit khí X (đktc) là sản phẩm khử duy nhất. Khí X là
A. NO B. NO2 C. NH3 D. N2
Câu 11: Hoà tan hỗn hợp gồm 0,1 mol Fe và 0,25 mol Al vào dung dịch HNO3 dư thu được hỗn hợp khí A gồn NO và NO2 có tỷ lệ số mol tương ứng là 2 : 1. Thể tích hỗn hợp khí A (đktc) là
A. 8,64 B. 10,08 C. 28 C. 12,8
Câu 12: Hoà tan hoàn toàn m(g) Fe3O4 vào dung dịch HNO3 được hỗn hợp khí NO và N2O có tỷ khối hơi đối với H2 bằng 16,75. Thể tích NO và N2O (đktc) lần lượt là
A. 22,4 ; 6,72 B. 2,016 ; 0,672 C. 0,672 ; 2,016 D. 1,972 ; 0,448
Câu 13: Cho 6,4g Cu hoà tan hoàn toàn vào HNO3 sau phản ứng thu được hỗn hợp khí NO và NO2 có tỉ khối so với H2 là 18. Nồng độ mol của HNO3 là
A. 1,44M B. 1,54M C. 1,34M D. 1,46M
Câu 14: Hoà tan 5,95g hỗn hợp Zn và Al có tỉ lệ mol 1:2 bằng dung dịch HNO3 loãng dư thu được 0,896 lit một sản phẩm khử duy nhất X chứa nitơ. Vậy X là:
A. NO2 B. N2 C. NO D. N2O
Câu 15: Cho m gam Al phản ứng hết với dung dịch HNO3 dư thu được 8,96 lit (đktc) hỗn hợp khí NO và N2O có tỉ khối đối với H2 là 18,5. Giá trị của m là:
A. 17,5 B. 15,3 C. 19,8 D. 13,5
---(Để xem nội dung đầy đủ, chi tiết của tài liệu vui lòng xem tại online hoặc đăng nhập để tải về máy)---
IV. Dạng toán nhiệt phân muối Nitrat
Câu 1: Các phương trình nhiệt phân muối nitrat sau, phương trình nào không đúng?
A. KNO3 → KNO2 + 1/2O2.
B. AgNO3 → AgO + NO2 + 1/2O2.
C. Ba(NO3)2 → BaO + 2NO2 + 1/2O2.
D. 2Fe(NO3)2 → Fe2O3 + 4NO2 + 3/2O2.
Câu 2: Nhiệt phân hoàn toàn Ba(NO3)2 trong bình kín, sản phẩm thu được là
A. BaNO2, O2
B. Ba, NO2, O2
C. BaO, NO2, O2
D. BaNO2, NO2, O2
Câu 3: Nung Fe(NO3)2 trong bình kín không có oxi, thu được sản phẩm là
A. FeO + NO2 + O2
B. Fe2O3 + NO2 + O2
C. Fe2O3 + NO2
D. FeO + NO2
Câu 4: Dãy chất nào sau đây khi nhiệt phân không tạo khí làm xanh quỳ ẩm
A. (NH4)2SO4, NaCl
B. NH4Cl, Na2CO3
C. (NH4)2CO3, NaNO3
D. NH4NO2, Cu(NO3)2
Câu 5: Thuốc nổ đen là hỗn hợp nào sau đây?
A. KNO3 + S
B. KClO3 + C
C. KClO3 + C + S
D. KNO3 + C + S
Câu 6: Trong phản ứng: KClO3 + NH3 → KNO3 + KCl + Cl2 + H2O. Hệ số cân bằng tối giản của NH3 trong phương trình là
A. 10 B. 1 C. 2 D. 6
Câu 7: Đun nóng hỗn hợp 2 muối rắn (NH4)2CO3 và NH4HCO3 thu được 13,44 lít khí NH3 và 11,2lít khí CO2. Thành phần % các muối theo khối lượng (các khí đo ở đktc) theo thứ tự là
A. 60%, 40%
B. 40%, 60%
C. 23,3%, 76,7%
D. 76,7%, 23,3%
Câu 8: Nhiệt phân hoàn toàn 18,8g muối Nitrat của kim loại M. Thu được 8g oxit kim loại tương ứng. M là kim loại nào
A. Cu B. Mg C. Fe D. Zn
Câu 9: Nung m gam Cu(NO3)2 sau thời gian thì dừng lại làm nguội và đem cân thấy khối lượng giảm đi 0,54g so với ban đầu. Khối lượng Cu(NO3)2 bị nhiệt phân là
A. 1,88g B. 0,47g C. 9,4g D. 0,94g
Câu 10: Nung hoàn toàn 27,3g hỗn hợp NaNO3 và Cu(NO3)2. Hỗn hợp khí thoát ra được dẫn vào H2O thì có 1,12 lít khí không bị hấp thụ. Khối lượng Cu(NO3)2 trong hỗn hợp là
A. 28,2g B. 8,6g C. 4,4g D. 18,8g
Câu 11: Đem nung 36,3 gam Fe(NO3)3 sau một thời gian thu được chất rắn có khối lượng 20,1gam. Thể tích O2 thu được (đktc) là
A. 4,376 lit B. 2,184 lit C. 1,69 lit D. 3,36 lit
Câu 12: Nhiệt phân 63,9 gam Al(NO3)3 sau phản ứng làm nguội và đem cân thấy khối lượng chất rắn thu được là 31,5 gam. Hiệu suất của phản ứng là
A. 49,3% B. 66,7% C. 69,8% D. 75,8%
Câu 13: Nhiệt phân m gam Fe(NO3)2 sau một thời gian đem cân lại thấy khối lượng chất rắn trong bình giảm 20gam. Khối lượng muối Fe(NO3)2 đã bị nhiệt phân là
A. 36,0g B. 33,3g C. 37,5g D. 25,71g
Câu 14: Nhiệt phân hoàn toàn m gam một muối amoni của axit cacbonic rồi dẫn toàn bộ sản phẩm vào 50 gam dung dịch H2SO4 19,6%, sau phản ứng thu được một muối trung hòa có nồng độ 23,913%. Công thức phân tử và giá trị m là
A. (NH4)2CO3 và 9,6
B. (NH4)2CO3 và 19,2
C. NH4HCO3 và 7,9
D. NH4HCO3 và 15,8
...
Trên đây là một phần trích đoạn nội dung Các dạng bài toán liên quan đến Chương 2 môn Hóa học 11 năm 2019-2020. Để xem toàn bộ nội dung các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập .
Các em quan tâm có thể tham khảo thêm các tài liệu cùng chuyên mục:
- Đề kiểm tra 1 tiết Chương 2 môn Hóa học 11 năm 2019-2020 Trường THPT Ngô Quyền
- Bài tập ôn tập Nito, Photpho, Silic môn Hóa học 11 năm 2019-2020
- 6 Dạng bài tập Chương 2 nhóm Nito - Photpho Hóa học 11
Chúc các em học tập tốt !







