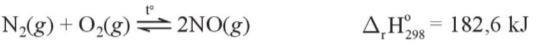Nitrogen l├Ā kh├Ł c├│ h├Ām lŲ░ß╗Żng lß╗øn nhß║źt trong kh├┤ng kh├Ł, c├│ vai tr├▓ cung cß║źp ─æß║Īm tß╗▒ nhi├¬n cho c├óy trß╗ōng, n├│ c├│ trong rß║źt nhiß╗üu hß╗Żp chß║źt quan trß╗Źng v├Ā thiß║┐t yß║┐u trong ─æß╗Øi sß╗æng. Nitrogen c├│ t├Łnh chß║źt g├¼ v├Ā c├│ nhß╗»ng ß╗®ng dß╗źng n├Āo?
Nß╗Öi dung l├Į thuyß║┐t v├Ā b├Āi tß║Łp minh hß╗Źa B├Āi 4: ─ÉŲĪn chß║źt nitrogen m├┤n H├│a hß╗Źc lß╗øp 11 C├Īnh diß╗üu sß║Į l├Ā ch├¼a kho├Ī gi├║p c├Īc em c├│ ─æŲ░ß╗Żc c├óu trß║Ż lß╗Øi. B├Āi giß║Żng ─æ├Ż ─æŲ░ß╗Żc HOC247 bi├¬n soß║Īn ngß║»n gß╗Źn, ─æß║¦y ─æß╗¦, dß╗ģ hiß╗āu vß╗ü trß║Īng th├Īi tß╗▒ nhi├¬n, cß║źu tß║Īo nguy├¬n tß╗Ł, ph├ón tß╗Ł, t├Łnh chß║źt vß║Łt l├Ł, ho├Ī hß╗Źc v├Ā ß╗®ng dß╗źng cß╗¦a nitrogen.
Ch├║c c├Īc em hß╗Źc tß╗æt!
T├│m tß║»t l├Į thuyß║┐t
1.1. Trß║Īng th├Īi tß╗▒ nhi├¬n cß╗¦a nguy├¬n tß╗æ nitrogen
- Nguy├¬n tß╗æ nitrogen c├│ k├Ł hiß╗ću ho├Ī hß╗Źc l├Ā N, sß╗æ hiß╗ću nguy├¬n tß╗Ł l├Ā 7, ─æß╗Ö ├óm ─æiß╗ćn l├Ā 3,04.
ŌĆō ß╗× trß║Īng th├Īi tß╗▒ nhi├¬n, nitrogen tß╗ōn tß║Īi ß╗¤ dß║Īng ─æŲĪn chß║źt v├Ā hß╗Żp chß║źt.
ŌĆō Trong kh├Ł quyß╗ān, nguy├¬n tß╗æ nitrogen tß╗ōn tß║Īi chß╗¦ yß║┐u dŲ░ß╗øi dß║Īng ─æŲĪn chß║źt N2, nitrogen chiß║┐m khoß║Żng 78% thß╗ā t├Łch cß╗¦a kh├┤ng kh├Ł.
ŌĆō Nitrogen trong tß╗▒ nhi├¬n l├Ā hß╗Śn hß╗Żp cß╗¦a hai ─æß╗ōng vß╗ŗ: 14N (99,63%) v├Ā 15N (0,37%).
ŌĆō ß╗× dß║Īng hß╗Żp chß║źt, nitrogen c├│ nhiß╗üu trong kho├Īng vß║Łt sodium nitrate (NaNO3) vß╗øi t├¬n gß╗Źi l├Ā di├¬m ti├¬u natri.
ŌĆō Trong ─æß║źt v├Ā nŲ░ß╗øc, nitrogen tß╗ōn tß║Īi chß╗¦ yß║┐u dŲ░ß╗øi dß║Īng ion nitrate (NO3-), nitrite (NO2-) v├Ā ammonium (NH4+).
ŌĆō Nitrogen c├▓n c├│ trong th├Ānh phß║¦n cß╗¦a protein, nucleic acid, ... v├Ā nhiß╗üu hß╗Żp chß║źt hß╗»u cŲĪ kh├Īc.
1.2. ─ÉŲĪn chß║źt nitrogen
a. ─Éß║Ęc ─æiß╗ām li├¬n kß║┐t
|
Ph├ón tß╗Ł N2 c├│ li├¬n kß║┐t ba giß╗»a hai nguy├¬n tß╗Ł nitrogen, cß║Ż hai nguy├¬n tß╗Ł n├Āy ─æß╗üu thoß║Ż m├Żn quy tß║»c octet vß╗øi c├┤ng thß╗®c Lewis nhŲ░ sau: :N\(\equiv \)N: |
b. T├Łnh chß║źt cŲĪ bß║Żn
T├Łnh k├®m hoß║Īt ─æß╗Öng ho├Ī hß╗Źc (t├Łnh trŲĪ) ß╗¤ nhiß╗ćt ─æß╗Ö thß║źp
- Li├¬n kß║┐t ba giß╗»a hai nguy├¬n tß╗Ł N trong ph├ón tß╗Ł nitrogen c├│ n─āng lŲ░ß╗Żng li├¬n kß║┐t rß║źt lß╗øn (946 kJ mol-1) n├¬n rß║źt kh├│ bß╗ŗ ph├Ī vß╗Ī.
- V├¼ vß║Ły, ß╗¤ nhiß╗ćt ─æß╗Ö v├Ā ├Īp suß║źt thŲ░ß╗Øng, nitrogen rß║źt kh├│ tham gia phß║Żn ß╗®ng.
- ─Éß║Ęc ─æiß╗ām n├Āy ─æŲ░ß╗Żc gß╗Źi l├Ā t├Łnh k├®m hoß║Īt ─æß╗Öng ho├Ī hß╗Źc hay tß╗ēnh trŲĪ cß╗¦a ─æŲĪn chß║źt nitrogen.
T├Łnh hoß║Īt ─æß╗Öng ho├Ī hß╗Źc ß╗¤ nhiß╗ćt ─æß╗Ö cao
- Phß║Żn ß╗®ng cß╗¦a nitrogen v├Ā hydrogen diß╗ģn ra thuß║Łn nghß╗ŗch, ─æŲ░ß╗Żc thß╗▒c hiß╗ćn ß╗¤ ─æiß╗üu kiß╗ćn nhiß╗ćt ─æß╗Ö v├Ā ├Īp suß║źt kh├Ī cao c├╣ng vß╗øi chß║źt x├║c t├Īc l├Ā bß╗Öt sß║»t.
- Nitrogen phß║Żn ß╗®ng vß╗øi oxygen ß╗¤ nhiß╗ćt ─æß╗Ö rß║źt cao, khoß║Żng 3000 ┬░C, tß║Īo ra nitrogen monoxide (NO).
- Trong khi quyß╗ān, phß║Żn ß╗®ng n├Āy ch├Łnh l├Ā sß╗▒ khß╗¤i ─æß║¦u cho qu├Ī tr├¼nh tß║Īo th├Ānh ion nitrate (NO3-), ─æŲ░ß╗Żc coi l├Ā mß╗Öt nguß╗ōn cung cß║źp ─æß║Īm cho ─æß║źt.
- TrŲ░ß╗øc ti├¬n, nitrogen monoxide ─æŲ░ß╗Żc tß║Īo th├Ānh tß╗½ nitrogen v├Ā oxygen khi c├│ sß║źm s├®t.
- Sau ─æ├│, nitrogen monoxide nhanh ch├│ng bß╗ŗ oxi ho├Ī bß╗¤i oxygen trong khi quyß╗ān tß║Īo th├Ānh nitrogen dioxide (NO2).
2NO(g) + O2(g) ŌåÆ 2NO2(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) = -116,2 kJ
- Tiß║┐p theo l├Ā qu├Ī tr├¼nh nitrogen dioxide chuyß╗ān th├Ānh acid trong nŲ░ß╗øc mŲ░a, c├│ thß╗ā ─æŲ░ß╗Żc m├┤ tß║Ż qua phß║Żn ß╗®ng:
4NO2(g) + 2H2O(l) + O2(g) ŌåÆ 4HNO3(aq)
- NŲ░ß╗øc mŲ░a vß╗øi nß╗ōng ─æß╗Ö acid ph├╣ hß╗Żp sß║Į gi├║p cung cß║źp ─æß║Īm cho ─æß║źt ß╗¤ dß║Īng ion nitrate cß║¦n thiß║┐t cho c├óy trß╗ōng.
1.3. ß╗©ng dß╗źng
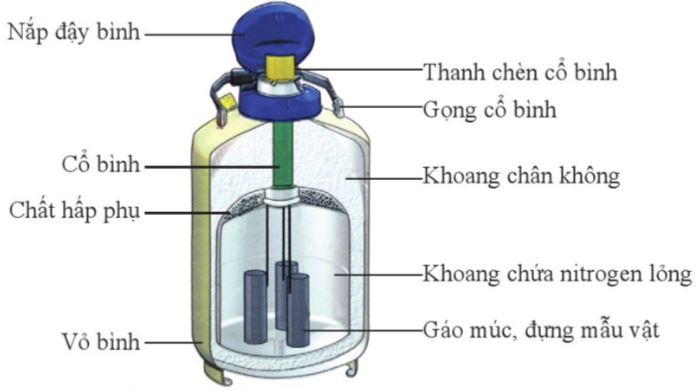
H├¼nh 4.1. Cß║źu tß║Īo cß╗¦a b├¼nh bß║Żo quß║Żn mß║½u vß║Łt bß║▒ng nitrogen lß╗Ång


H├¼nh 4.2. Mß╗Öt sß╗æ ß╗®ng dß╗źng cß╗¦a nitrogen
B├Āi tß║Łp minh hß╗Źa
B├Āi 1. Kh├Ł N2 tŲ░ŲĪng ─æß╗æi trŲĪ ß╗¤ nhiß╗ćt ─æß╗Ö thŲ░ß╗Øng l├Ā do
A. Nitrogen c├│ b├Īn k├Łnh nguy├¬n tß╗Ł nhß╗Å, ph├ón tß╗Ł kh├┤ng ph├ón cß╗▒c
B. Nguy├¬n tß╗Ł nitrogen c├│ ─æß╗Ö ├óm ─æiß╗ćn lß╗øn nhß║źt trong nh├│m VA
C. Trong ph├ón tß╗Ł N2, mß╗Śi nguy├¬n tß╗Ł c├▓n mß╗Öt cß║Ęp electron chŲ░a tham gia li├¬n kß║┐t
D. Trong ph├ón tß╗Ł N2 chß╗®a li├¬n kß║┐t 3 rß║źt bß╗ün
HŲ░ß╗øng dß║½n giß║Żi
Kh├Ł N2 tŲ░ŲĪng ─æß╗æi trŲĪ ß╗¤ nhiß╗ćt ─æß╗Ö thŲ░ß╗Øng l├Ā do trong ph├ón tß╗Ł N2 chß╗®a li├¬n kß║┐t 3 rß║źt bß╗ün.
\(\Rightarrow\) Chß╗Źn D
B├Āi 2. ŌĆ£L├║a chi├¬m lß║źp l├│ ─æß║¦u bß╗Ø Hß╗ģ nghe tiß║┐ng sß║źm phß║źt cß╗Ø m├Ā l├¬nŌĆØ Hai c├óu tr├¬n m├┤ tß║Ż cho phŲ░ŲĪng tr├¼nh h├│a hß╗Źc n├Āo sau ─æ├óy?
A. N2 + O2 ŌåÆ 2NO
B. 2NH3+ CO2 ŌåÆ (NH2)2CO + H2O
C. 2NO + O2 ŌåÆ 2NO2
D. (NH2)2CO + 2H2O ŌåÆ (NH4)2CO3
HŲ░ß╗øng dß║½n giß║Żi
─É├Īp ├Īn A
- L├║a chi├¬m lß║źp l├│ ─æß║¦u bß╗Ø ngh─®a l├Ā l├║a ─æang rß║źt cß║¦n dinh dŲ░ß╗Īng cho qu├Ī tr├¼nh sinh trŲ░ß╗¤ng
- Khi c├│ sß║źm tß╗®c l├Ā tß║Īo ra sß╗▒ ph├│ng ─æiß╗ćn trong kh├┤ng kh├Ł, nhiß╗ćt ─æß╗Ö l├║c n├Āy l├Ā khoß║Żng 30000C. Li├¬n kß║┐t NŌēĪN trong N2 b├¼nh thŲ░ß╗Øng rß║źt bß╗ün nhŲ░ng ß╗¤ mß╗®c nhiß╗ćt n├Āy th├¼ bß╗ŗ ph├Ī vß╗Ī li├¬n kß║┐t ŌćÆ N2 phß║Żn ß╗®ng ngay vß╗øi O2
N2(g) + O2(g) \(\rightleftharpoons\) (30000C) 2NO(g)
- NO lß║Īi phß║Żn ß╗®ng ngay vß╗øi O2 tß║Īo ra NO2 (kh├Ł c├│ m├Āu n├óu).
2NO(g) + O2(g) ŌåÆ 2NO2(g)
- Khi ─æ├│ c├│ mŲ░a th├¼ sß║Į c├│ phß║Żn ß╗®ng tß║Īo ra HNO3
4NO2(g) + O2(g) + 2H2O(aq) ŌåÆ 4HNO3(aq)
- L├║c n├Āy HNO3 dß╗ģ d├Āng phß║Żn ß╗®ng vß╗øi nhiß╗üu chß║źt (chß╗¦ yß║┐u l├Ā gß╗æc kim loß║Īi R+ hoß║Ęc NH4+) ─æß╗ā tß║Īo th├Ānh muß╗æi nitrate ŌćÆ rß║źt nhiß╗üu dinh dŲ░ß╗Īng cho c├óy hß║źp thß╗ź ngay lß║Łp tß╗®c ŌćÆ "phß║źt cß╗Ø m├Ā l├¬n"
NH4+ + NO3- ŌåÆ NH4NO3
R+ + NO3- ŌåÆ RNO3
Luyß╗ćn tß║Łp B├Āi 4 H├│a 11 C├Īnh Diß╗üu
Hß╗Źc xong b├Āi hß╗Źc n├Āy, em c├│ thß╗ā:
ŌĆō Ph├Īt biß╗āu ─æŲ░ß╗Żc trß║Īng th├Īi tß╗▒ nhi├¬n cß╗¦a nguy├¬n tß╗æ nitrogen.
ŌĆō Giß║Żi th├Łch ─æŲ░ß╗Żc t├Łnh trŲĪ cß╗¦a ─æŲĪn chß║źt nitrogen ß╗¤ nhiß╗ćt ─æß╗Ö thŲ░ß╗Øng th├┤ng qua li├¬n kß║┐t v├Ā gi├Ī trß╗ŗ n─āng lŲ░ß╗Żng li├¬n kß║┐t; c├Īc ß╗®ng dß╗źng cß╗¦a ─æŲĪn chß║źt nitrogen kh├Ł v├Ā lß╗Ång trong sß║Żn xuß║źt, trong hoß║Īt ─æß╗Öng nghi├¬n cß╗®u.
ŌĆō Tr├¼nh b├Āy ─æŲ░ß╗Żc sß╗▒ hoß║Īt ─æß╗Öng cß╗¦a ─æŲĪn chß║źt nitrogen ß╗¤ nhiß╗ćt ─æß╗Ö cao ─æß╗æi vß╗øi hydrogen, oxygen. Li├¬n hß╗ć ─æŲ░ß╗Żc qu├Ī tr├¼nh tß║Īo v├Ā cung cß║źp nitrate cho ─æß║źt tß╗½ nŲ░ß╗øc mŲ░a.
3.1. Trß║»c nghiß╗ćm B├Āi 4 H├│a 11 C├Īnh Diß╗üu
C├Īc em c├│ thß╗ā hß╗ć thß╗æng lß║Īi nß╗Öi dung kiß║┐n thß╗®c ─æ├Ż hß╗Źc ─æŲ░ß╗Żc th├┤ng qua b├Āi kiß╗ām tra Trß║»c nghiß╗ćm H├│a hß╗Źc 11 CD B├Āi 4 cß╗▒c hay c├│ ─æ├Īp ├Īn v├Ā lß╗Øi giß║Żi chi tiß║┐t.
-
Câu 1:
Cho c├Īc ph├Īt biß╗āu sau vß╗ü t├Łnh chß║źt vß║Łt l├Ł cß╗¦a nitrogen. Ph├Īt biß╗āu kh├┤ng ─æ├║ng l├Ā
- A. Nitrogen l├Ā chß║źt kh├Ł kh├┤ng m├Āu
- B. Nhß║╣ hŲĪn kh├┤ng kh├Ł
- C. Tan nhiß╗üu trong nŲ░ß╗øc
- D. Kh├┤ng duy tr├¼ sß╗▒ ch├Īy v├Ā sß╗▒ h├┤ hß║źp
-
- A. 6
- B. 7
- C. 8
- D. 9
-
- A. Chß║źt kh├Ł kh├┤ng m├Āu
- B. Chß║źt rß║»n m├Āu ─æen
- C. Chß║źt lß╗Ång m├Āu v├Āng nhß║Īt
- D. Huyền phù
C├óu 4-10: Mß╗Øi c├Īc em ─æ─āng nhß║Łp xem tiß║┐p nß╗Öi dung v├Ā thi thß╗Ł Online ─æß╗ā cß╗¦ng cß╗æ kiß║┐n thß╗®c vß╗ü b├Āi hß╗Źc n├Āy nh├®!
3.2. B├Āi tß║Łp SGK B├Āi 4 H├│a 11 C├Īnh Diß╗üu
C├Īc em c├│ thß╗ā xem th├¬m phß║¦n hŲ░ß╗øng dß║½n Giß║Żi b├Āi tß║Łp H├│a hß╗Źc 11 CD B├Āi 4 ─æß╗ā gi├║p c├Īc em nß║»m vß╗»ng b├Āi hß╗Źc v├Ā c├Īc phŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp.
Mß╗¤ ─æß║¦u trang 26 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Giß║Żi C├óu hß╗Åi 1 trang 26 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Luyß╗ćn tß║Łp 1 trang 27 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Giß║Żi C├óu hß╗Åi 2 trang 27 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Luyß╗ćn tß║Łp 2 trang 27 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Giß║Żi B├Āi 1 trang 29 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Giß║Żi B├Āi 2 trang 29 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Giß║Żi B├Āi 3 trang 29 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Hß╗Åi ─æ├Īp B├Āi 4 H├│a 11 C├Īnh Diß╗üu
Trong qu├Ī tr├¼nh hß╗Źc tß║Łp nß║┐u c├│ thß║»c mß║»c hay cß║¦n trß╗Ż gi├║p g├¼ th├¼ c├Īc em h├Ży comment ß╗¤ mß╗źc Hß╗Åi ─æ├Īp, Cß╗Öng ─æß╗ōng H├│a hß╗Źc HOC247 sß║Į hß╗Ś trß╗Ż cho c├Īc em mß╗Öt c├Īch nhanh ch├│ng!
Ch├║c c├Īc em hß╗Źc tß║Łp tß╗æt v├Ā lu├┤n ─æß║Īt th├Ānh t├Łch cao trong hß╗Źc tß║Łp!