Nội dung chi tiết và hướng dẫn giải bài tập Bài 6: Sulfur và sulfur dioxide môn Hóa học 11 Cánh diều được HOC247 biên soạn dưới đây sẽ giúp các em dễ dàng nắm được kiến thức quan trọng và làm tốt bài tập về sulfur và sulfur dioxide – hai hợp chất quan trọng trong hóa học và sản xuất công nghiệp.
Hãy cùng khám phá bài học này để hiểu rõ hơn về tính chất, ứng dụng của sulfur và sulfur dioxide cũng như tác động của chúng đến môi trường và sức khỏe con người nhé. Chúc các em học tốt.
Tóm tắt lý thuyết
1.1. Sulfur
a. Trạng thái tự nhiên
- Sulfur có kí hiệu hoá học là S, số hiệu nguyên tử là 16, độ âm điện là 2.58
- Trong tự nhiên, sulfur tồn tại ở cả dạng đơn chất và hợp chất. Đơn chất sulfur được tìm thấy chủ yếu tại các vùng có núi lửa, nhiều nhất ở các nước thuộc “vành đai lửa” Thái Bình Dương.
- Ở điều kiện thường, sulfur là chất rắn, có thể tồn tại ở dạng bột (Hình 6.1) hoặc tinh thể như hình dưới đây.
Mẫu khoáng vật sulfur khai thác từ mỏ
Hình 6.1. Khai thác bột sulfur trên miệng núi lửa ở đảo Java, Indonesia
b. Tính chất
Tính chất vật lí
- Ở điều kiện thưởng, đơn chất sulfur là chất rắn, có màu vàng, không tan trong nước, tan ít trong ethanol, tan nhiều trong dầu hoả, benzene.
- Sulfur nóng chảy ở khoảng 113 °C, hoá hơi ở khoảng 445 °C.
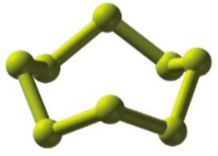
Cấu tạo phân tử S8 của sulfur
Tính chất hoá học
- Ở điều kiện thường, phân tử đơn chất sulfur gồm 8 nguyên tử S (S8). Để đơn giản, người ta dùng kí hiệu S mà không dùng công thức phân tử S8 trong các phản ứng hoá học.
- Khi tham gia phản ứng hoá học, sulfur thể hiện tính oxi hoá hoặc tính khử.
Tính oxi hoá
|
Sulfur phản ứng với nhiều kim loại, hydrogen tạo ra các hợp chất sulfide. |
Ví dụ:
\(\begin{align} & \overset{0}{\mathop{S}}\,(s)+\overset{0}{\mathop{Fe}}\,(s)\xrightarrow{{{t}^{o}}}\overset{+2}{\mathop{Fe}}\,\overset{-2}{\mathop{S}}\,(s) \\ & \overset{0}{\mathop{S}}\,(s)+\overset{0}{\mathop{Hg}}\,(l)\xrightarrow{{{t}^{o}}}\overset{+2}{\mathop{Hg}}\,\overset{-2}{\mathop{S}}\,(s) \\ \end{align}\)
- Trong các phản ứng trên, số oxi hoá của sulfur đã giảm từ 0 xuống -2.
Tính khử
|
Ở nhiệt độ thích hợp, sulfur phản ứng với một số phi kim như oxygen, chlorine, fluorine. Trong các phản ứng đó, số oxi hoá của sulfur tăng. |
Ví dụ: \(\begin{array}{*{35}{l}} \overset{0}{\mathop{\text{ }S}}\,(s)+\overset{0}{\mathop{{{O}_{2}}}}\,(g)\xrightarrow{{{t}^{o}}}\overset{+4}{\mathop{S}}\,{{\overset{-2}{\mathop{O}}\,}_{2}}(s) \\ \end{array}\,\,\,\,\,\,\,\,\,{{\Delta }_{\text{r}}}\text{H}_{\text{298}}^{\text{0}}=-296,8\,kJ\)
Ứng dụng
− Lưu hoá cao su
− Sản xuất sulfuric acid
− Sản xuất diêm, thuốc nổ
− Sản xuất thuốc trừ sâu, thuốc diệt nấm

Hình 6.2. Một số ứng dụng của sulfur
1.2. Sulfur dioxide
a. Một số tính chất
- Ở điều kiện thường, sulfur dioxide (SO2) là chất khí không màu, có mùi hắc, độc, tan nhiều trong nước.
- Sulfur dioxide thể hiện tính chất của acidic oxide như phản ứng với nước tạo môi trường acid, phản ứng với basic oxide hoặc base tạo thành muối.
- Sulfur dioxide (SO2) thể hiện cả tính oxi hoá và tính khử.
Ví dụ: ![]()
\(\begin{array}{*{35}{l}} S{{O}_{2}}\left( g \right)\text{ }+\text{ }{{H}_{2}}S\left( g \right)\text{ }\to \text{ }3S\left( s \right)\text{ }+\text{ }2{{H}_{2}}O\left( l \right) \\ 2S{{O}_{2}}\left( g \right)\text{ }+\text{ }{{O}_{2}}\left( g \right)\text{ }\xrightarrow{NO\ hoặc\ N{{O}_{2}}}\text{ }2S{{O}_{3}}\left( g \right) \\ \end{array}\)
b. Ứng dụng
- Sulfur dioxide là chất trung gian quan trọng trong quá trình sản xuất sulfuric acid.
- Oxide này còn được dùng để tẩy trắng vải sợi, đường, sản xuất thuốc trừ sâu và thuốc sát trùng.
- Trong công nghệ thực phẩm trước kia, sulfur dioxide cũng được sử dụng ở nồng độ nhất định để hạn chế sự phát triển của vi sinh vật.
- Khí sulfur dioxide cũng được tạo ra từ quá trình đốt cháy sulfur với mục dích diệt khuẩn và nấm mốc, được dùng để bảo quản hoa quả sấy khô, dược liệu từ thực vật (dân gian còn gọi là quá trình “xông sinh").
- Tuy nhiên, hiện nay, biện pháp bảo quản này đã bị cấm sử dụng do gây nhiễm độc thực phẩm.
1.3. Một số biện pháp giảm thải sulfur dioxide vào khí quyển
– Sulfur dioxide được sinh ra trong tự nhiên và do tác động của con người.

Hình 6.3. Một số nguồn phát thải sulfur dioxide
– Để giảm thiểu lượng khí thải này cần kết hợp thực hiện một số các biện pháp sau, tuỳ thuộc vào nguồn thải SO2.
– Sử dụng các nguồn nhiên liệu sinh học thân thiện với môi trường như hydrogen, ethanol, ... thay cho nguồn năng lượng hoá thạch.
– Khai thác các nguồn năng lượng tái tạo như năng lượng mặt trời, năng lượng gió, mưa, sóng biển, thuỷ triều, địa nhiệt.
– Xử lí khí thải công nghiệp trước khi thải ra môi trường.
Bài tập minh họa
Bài 1. S vừa là chất khử, vừa là chất oxi hóa trong phản ứng nào sau đây ?
A. S + O2 \(\to\) SO2
B. S + 6HNO3 \(\to\) H2SO4 + 6NO2 + 2H2O
C. S + Mg \(\to\) MgS
D. S + 6NaOH \(\to\) 2Na2S + Na2SO3 + 3H2O
Hướng dẫn giải
S vừa là chất khử, vừa là chất oxi hóa khi số oxi hoá của S vừa tăng, vừa giảm sau phản ứng:
\(\begin{array}{*{35}{l}} A.\text{ }\overset{0}{\mathop{S}}\,\text{ }+\text{ }{{O}_{2}}~\to \text{ }\overset{+4}{\mathop{S}}\,{{O}_{2}} \\ B.\text{ }\overset{0}{\mathop{S}}\,\text{ }+\text{ }6HN{{O}_{3}}~\to \text{ }{{H}_{2}}\overset{+6}{\mathop{S}}\,{{O}_{4}}~+\text{ }6N{{O}_{2}}~+\text{ }2{{H}_{2}}O \\ C.\text{ }\overset{0}{\mathop{S}}\,\text{ }+\text{ }Mg\text{ }\to \text{ }Mg\overset{-2}{\mathop{S}}\, \\ D.\text{ }\overset{0}{\mathop{S}}\,\text{ }+\text{ }6NaOH\text{ }\to \text{ }2N{{a}_{2}}\overset{-2}{\mathop{S}}\,\text{ }+\text{ }N{{a}_{2}}\overset{+4}{\mathop{S}}\,{{O}_{3}}~+\text{ }3{{H}_{2}}O \\ \end{array}\)
⇒ Chọn D
Bài 2. So sánh tính chất cơ bản của oxygen và sulfur ta có
A. tính oxi hoá của oxygen < sulfur
B. tính khử của sulfur > oxygen
C. tính oxi hoá của oxygen = tính oxi hoá của S
D. tính khử của oxygen = tính khử của S
Hướng dẫn giải
Tính oxi hoá của oxygen mạnh hơn sulfur; tính khử của sulfur mạnh hơn oxygen.
\(\Rightarrow\) Chọn B
Luyện tập Bài 6 Hóa 11 Cánh Diều
Học xong bài học này, em có thể:
- Nêu được các trạng thái tự nhiên của nguyên tố sulfur.
- Trình bày được cấu tạo, tính chất vật lí, hoá học cơ bản và ứng dụng của sulfur đơn chất, tính oxi hoá, tính khử và ứng dụng của sulfur dioxide và sự hình thành sulfur dioxide do tác động của con người, tự nhiên, tác hại của sulfur dioxide và một số biện pháp làm giảm thiểu lượng sulfur dioxide thải vào không khí
- Thực hiện được thí nghiệm chứng minh sulfur đơn chất vừa có tính oxi hoá vừa có tính khử
3.1. Trắc nghiệm Bài 6 Hóa 11 Cánh Diều
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 11 CD Bài 6 cực hay có đáp án và lời giải chi tiết.
-
- A. Fe.
- B. Fe và FeS.
- C. FeS.
- D. S và FeS.
-
- A. N2O.
- B. CO2.
- C. SO2.
- D. NO2.
-
- A. chất rắn màu vàng
- B. không tan trong nước
- C. có tnc thấp hơn ts của nước
- D. tan nhiều trong benzene
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 6 Hóa 11 Cánh Diều
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 11 CD Bài 6 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Mở đầu trang 39 SGK Hóa học 11 Cánh diều – CD
Giải Câu hỏi 1 trang 40 SGK Hóa học 11 Cánh diều – CD
Thí nghiệm 1 trang 40 SGK Hóa học 11 Cánh diều – CD
Thí nghiệm 2 trang 40 SGK Hóa học 11 Cánh diều – CD
Luyện tập 1 trang 41 SGK Hóa học 11 Cánh diều – CD
Luyện tập 2 trang 41 SGK Hóa học 11 Cánh diều – CD
Giải Câu hỏi 2 trang 42 SGK Hóa học 11 Cánh diều – CD
Luyện tập 3 trang 42 SGK Hóa học 11 Cánh diều – CD
Giải Câu hỏi 3 trang 42 SGK Hóa học 11 Cánh diều – CD
Vận dụng trang 43 SGK Hóa học 11 Cánh diều – CD
Giải Bài 1 trang 43 SGK Hóa học 11 Cánh diều – CD
Giải Bài 2 trang 43 SGK Hóa học 11 Cánh diều – CD
Giải Bài 3 trang 43 SGK Hóa học 11 Cánh diều – CD
Hỏi đáp Bài 6 Hóa 11 Cánh Diều
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!