Các aldehyde, ketone tạo nên mùi thơm đặc trưng của các loài động vật và thực vật. Nhiều aldehyde, ketone đóng vai trò quan trọng đối với cơ thể: tế bào trong võng mạc giúp mắt tiếp nhận ánh sáng được tạo thành từ aldehyde, các hormone giới tính nam và nữ là các ketone.
Nội dung chi tiết và hướng dẫn giải bài tập Bài 23 Hợp chất carbonyl môn Hóa học 11 Kết Nối Tri Thức được HOC247 biên soạn dưới đây sẽ giúp các em dễ dàng nắm được kiến thức quan trọng về hợp chất carbonyl, bao gồm các khái niệm, danh pháp, các tính chất vật lí, hoá học, ứng dụng và phương pháp điều chế một số hợp chất aldehyde, ketone.
Tóm tắt lý thuyết
1.1. Khái niệm, danh pháp
a. Khái niệm
|
Hợp chất carbonyl là các hợp chất hữu cơ trong phân tử có chứa nhóm chức carbonyl (C=O ). Nhóm chức carbonyl có trong aldehyde, ketone,... |
– Aldehyde là hợp chất hữu cơ có nhóm –CHO liên kết với nguyên tử carbon (trong gốc hydrocarbon hoặc CHO) hoặc nguyên tử hydrogen.
– Ketone là hợp chất hữu cơ có nhóm C=O liên kết với hai gốc hydrocarbon.
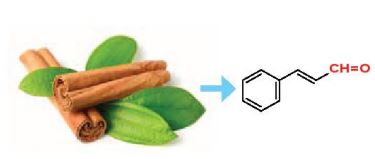
Hình 23.1. Cinnamaldehyde là một hợp chất aldehyde có trong tinh dầu quế
Hình 23.2. Menthone là một hợp chất ketone có trong tinh dầu bạc hà
b. Danh pháp
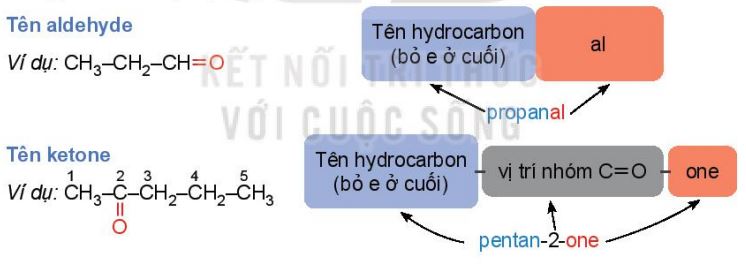
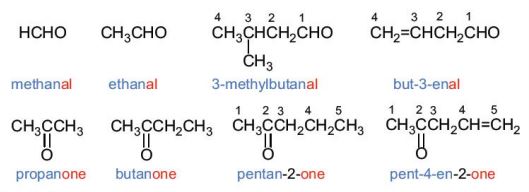
Danh pháp thay thế
Tên gọi theo danh pháp thay thế của aldehyde đơn chức và ketone đơn chức:
|
– Mạch carbon là mạch dài nhất chứa nhóm \(\rangle C=O\) – Mạch carbon được đánh số từ nhóm –CHO (đối với aldehyde) hoặc từ phía gần nhóm \(\rangle C=O\) hơn (đối với ketone). – Đối với ketone, nếu nhóm \(\rangle C=O\) chỉ có một vị trí duy nhất thì không cần số chỉ vị trí nhóm \(\rangle C=O\). – Nếu mạch carbon có nhánh thi cần thêm vị trí và tên nhánh ở phía trước. |
Ví dụ:
Tên gọi thông thường
Một số aldehyde, ketone đơn giản được gọi theo tên thông thường có nguồn gốc lịch sử. Tên thông thường của các aldehyde có nguồn gốc từ tên của acid tương ứng.
Ví dụ:
HCHO aldehyde formic (formaldehyde)
CH3CHO aldehyde acetic (acetaldehyde)
C6H5CHO aldehyde benzoic (benzaldehyde)
CH3COCH3 acetone
1.2. Đặc điểm cấu tạo
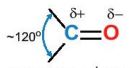
Liên kết đôi C=O phân cực về phía nguyên tử oxygen (Hình 23.3).
Hình 23.3. Cấu trúc nhóm carbonyl
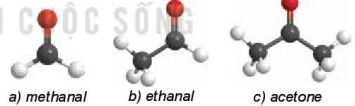
Hình 23.4. Mô hình phân tử của một số hợp chất carbonyl
1.3. Tính chất vật lí
– Các aldehyde, ketone có nhiệt độ sôi cao hơn các hydrocarbon có khối lượng phân tử tương đương do trong phân tử chứa nhóm carbonyl phân cực làm cho phân tử aldehyde, ketone phân cực nên có nhiệt độ sôi cao hơn.
– Ở nhiệt độ thường, các aldehyde có phân tử khối nhỏ (methanal, ethanal) ở trạng thái khí, các hợp chất carbonyl thông dụng khác ở trạng thái lỏng.
– Các aldehyde, ketone có mạch carbon ngắn tan tốt trong nước. Khi số nguyên tử carbon tăng thì độ tan của hợp chất carbonyl giảm dần.
Bảng 23.1. Nhiệt độ sôi và tính tan của một số hợp chất carbonyl (1)
1.4. Tính chất hoá học
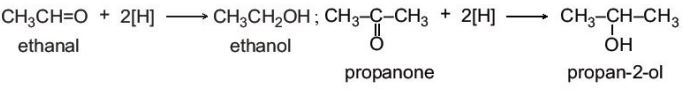
a. Phản ứng khử
– Các hợp chất carbonyl bị khử bởi các tác nhân khử như NaBH4, LiAlH4,... (kí hiệu: [H]) tạo thành các alcohol tương ứng: aldehyde bị khử tạo thành alcohol bậc I, ketone bị khử tạo thành alcohol bậc II.
Ví dụ:
b. Phản ứng oxi hoá aldehyde
– Aldehyde dễ bị oxi hoá bởi các tác nhân oxi hoá thông thường như: Br2/H2O, [Ag(NH3)2OH], Cu(OH)2/OH–....
Oxi hoá aldehyde bởi nước bromine
– Aldehyde bị oxi hoá bởi nước bromine tạo thành carboxylic acid.
Ví dụ: CH3CHO + Br2 + H2O → CH3COOH + 2HBr
Oxi hoá aldehyde bởi thuốc thử Tollens
– Thuốc thử Tollens là phức chất của ion Ag+ với ammonia, có công thức [Ag(NH3)2]OH. Ion Ag+ trong thuốc thử Tollens đóng vai trò là chất oxi hoá:
Ví dụ:
RCHO + 2[Ag(NH3)2]OH \(\xrightarrow{{{t}^{o}}}\) RCOONH4 + 2Ag + 3NH3 + H2O
CH3CHO + 2[Ag(NH3)2]OH \(\xrightarrow{{{t}^{o}}}\) CH3COONH4 + 2Ag + 3NH3 + H2O
– Phản ứng tạo thành lớp bạc sáng bóng bám vào bình phản ứng, vì vậy phản ứng này còn được gọi là phản ứng tráng bạc.
|
Ketone không bị oxi hoá bởi thuốc thử Tollens, vì vậy có thể dùng thuốc thử Tollens để phân biệt aldehyde với ketone và các hợp chất khác. |
Oxi hoá aldehyde bằng copper(II) hydroxide
– Aldehyde có thể bị oxi hoá bởi copper(II) hydroxide Cu(OH)2 trong môi trường kiềm khi đun nóng tạo thành kết tủa copper(I) oxide (Cu2O) màu đỏ gạch
RCHO + 2Cu(OH)2 + NaOH \(\xrightarrow{{{t}^{o}}}\) RCOONa + Cu2O +3H2O
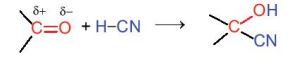
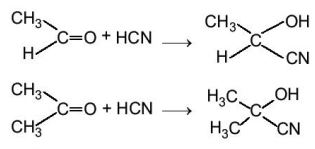
c. Phản ứng cộng
Hợp chất carbonyl có thể tham gia phản ứng cộng với HCN vào liên kết đôi C=O.
Ví dụ:
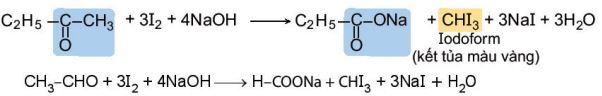
d. Phản ứng tạo iodoform
Các hợp chất aldehyde, ketone có nhóm methyl cạnh nhóm carbonyl có thể phản ứng với I2 trong môi trường kiềm.
Ví dụ:
Hình 23.7. Phản ứng iodoform
| Phản ứng tạo sản phẩm kết tủa iodoform nên phản ứng này được gọi là phản ứng iodoform và được dùng để nhận biết các aldehyde, ketone có nhóm methyl cạnh nhóm carbonyl. |
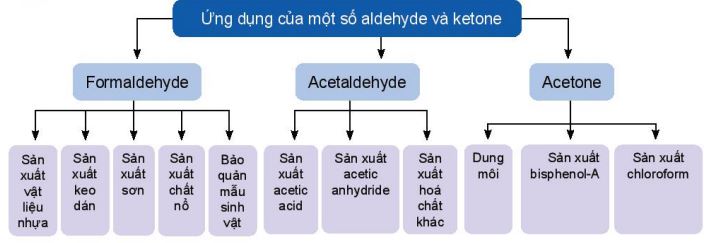
1.5. Ứng dụng
1.6. Điều chế
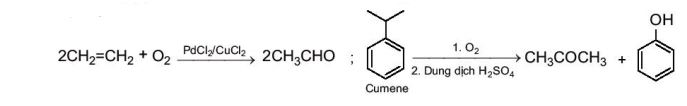
Một số hợp chất carbonyl được tổng hợp trong công nghiệp bằng phương pháp oxi hoá các hydrocarbon, oxi hoá ethylene thành acetaldehyde, oxi hoá cumene thành acetone (quy trình cumene, xem Bài 21. Phenol).
Ví dụ:
Bài tập minh họa
Bài 1. Cho các nhận định sau:
(a) Aldehyde là hợp chất chỉ có tính khử.
(b) Aldehyde cộng hydrogen thành alcohol bậc một.
(c) Aldehyde tác dụng với AgNO3/NH3 tạo thành Ag.
(d) Aldehyde no, đơn chức, mạch hở có công thức tổng quát CnH2nO.
Số nhận định đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Hướng dẫn giải
Các nhận định đúng là:
(b) Aldehyde cộng hydrogen thành alcohol bậc một.
(c) Aldehyde tác dụng với AgNO3/NH3 tạo thành Ag.
(d) Aldehyde no, đơn chức, mạch hở có công thức tổng quát CnH2nO.
Bài 2. Phản ứng nào sau đây không tạo aldehyde acetic?
A. Cho acetylene phản ứng với nước.
B. Oxi hóa không hoàn toàn ethylene.
C. Oxi hóa không hoàn toàn ethyl alcohol.
D. Oxi hóa không hoàn toàn methyl alcohol.
Hướng dẫn giải
Oxi hóa không hoàn toàn methyl alcohol thu được HCHO (aldehyde formic)
Luyện tập Bài 23 Hóa 11 Kết Nối Tri Thức
Học xong bài học này, em có thể:
– Nêu được khái niệm, tính chất vật lí hợp chất carbonyl (aldehyde và ketone).
– Gọi được tên theo danh pháp thay thế một số hợp chất carbonyl đơn giản (C1–C5), tên thông thường một vài hợp chất carbonyl thường gặp.
– Mô tả được đặc điểm liên kết của nhóm chức carbonyl, hình dạng phân tử của methanal, ethanal.
– Trình bày được tính chất hoá học của aldehyde; ứng dụng của hợp chất carbonyl và phương pháp điều chế acetaldehyde.
3.1. Trắc nghiệm Bài 23 Hóa 11 Kết Nối Tri Thức
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 11 KNTT Bài 23 cực hay có đáp án và lời giải chi tiết.
-
- A. Na.
- B. H2.
- C. O2.
- D. dung dịch AgNO3/NH3.
-
- A. 3
- B. 2
- C. 4
- D. 5
-
- A. Dùng để sản xuất nhựa phenol-fomaldehyde.
- B. Dùng để sản xuất nhựa urea-formaldehyde.
- C. Dùng để tẩy uế, ngâm mẫu động vật.
- D. Dùng để sản xuất acetic acid.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 23 Hóa 11 Kết Nối Tri Thức
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 11 KNTT Bài 23 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Mở đầu trang 136 SGK Hóa học 11 Kết nối tri thức – KNTT
Giải Câu hỏi 1 trang 138 SGK Hóa học 11 Kết nối tri thức – KNTT
Giải Câu hỏi 2 trang 138 SGK Hóa học 11 Kết nối tri thức – KNTT
Hoạt động trang 138 SGK Hóa học 11 Kết nối tri thức – KNTT
Giải Câu hỏi 3 trang 139 SGK Hóa học 11 Kết nối tri thức – KNTT
Thí nghiệm trang 140 SGK Hóa học 11 Kết nối tri thức – KNTT
Hoạt động trang 141 SGK Hóa học 11 Kết nối tri thức – KNTT
Giải Câu hỏi 4 trang 141 SGK Hóa học 11 Kết nối tri thức – KNTT
Hoạt động trang 142 SGK Hóa học 11 Kết nối tri thức – KNTT
Giải Câu hỏi 5 trang 142 SGK Hóa học 11 Kết nối tri thức – KNTT
Giải Câu hỏi 6 trang 142 SGK Hóa học 11 Kết nối tri thức – KNTT
Hoạt động trang 143 SGK Hóa học 11 Kết nối tri thức – KNTT
Em có thể trang 144 SGK Hóa học 11 Kết nối tri thức – KNTT
Hỏi đáp Bài 23 Hóa 11 Kết Nối Tri Thức
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!



.JPG)