Catechin là một hợp chất phenol có trong lá chè xanh. Catechin có tác dụng chống oxi hoá, diệt khuẩn, kháng viêm, ngăn ngừa một số bệnh về tim mạch, cao huyết áp, tiêu hoá, làm chậm quá trình lão hoá,... Vậy hợp chất phenol là gì và có các tính chất đặc trưng nào? Các em hãy cùng HOC247 tìm hiểu qua nội dung Bài 17: Phenol môn Hoá học 11 Cánh diều nhé!
Tóm tắt lý thuyết
1.1. Khái niệm
a. Khái niệm
|
Phenol là hợp chất trong phân tử có một hoặc nhiều nhóm hydroxy liên kết trực tiếp với nguyên tử carbon của vòng benzene. |
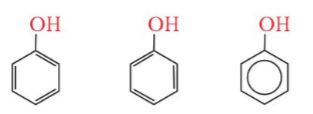
– Phenol cũng là tên của chất đơn giản nhất (monohydroxybenzene) trong nhóm các hợp chất phenol, có công thức cấu tạo C6H5-OH.
Hình 17.1. Công thức cấu tạo của phenol
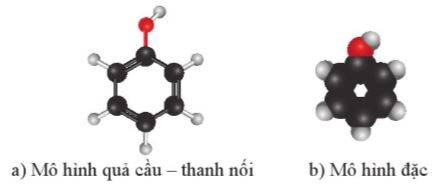
Hình 17.2. Mô hình phân tử của phenol
b. Phân loại
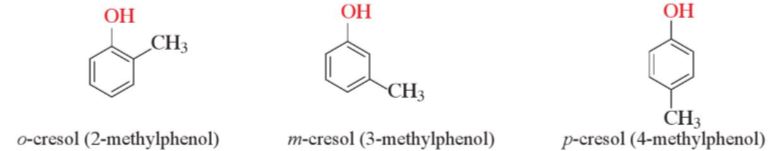
– Những phenol trong phân tử chứa một nhóm -OH thuộc loại monophenol. Chẳng hạn: phenol, o-cresol, m-cresol, p-cresol:
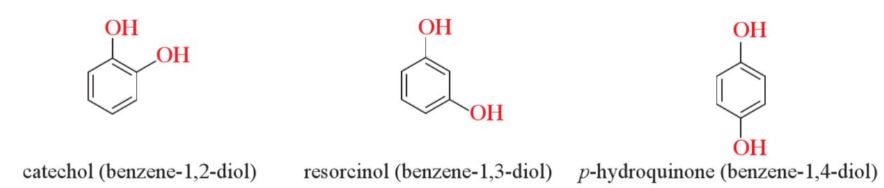
– Những phenol trong phân tử chứa nhiều nhóm -OH thuộc loại polyphenol. Chẳng hạn:
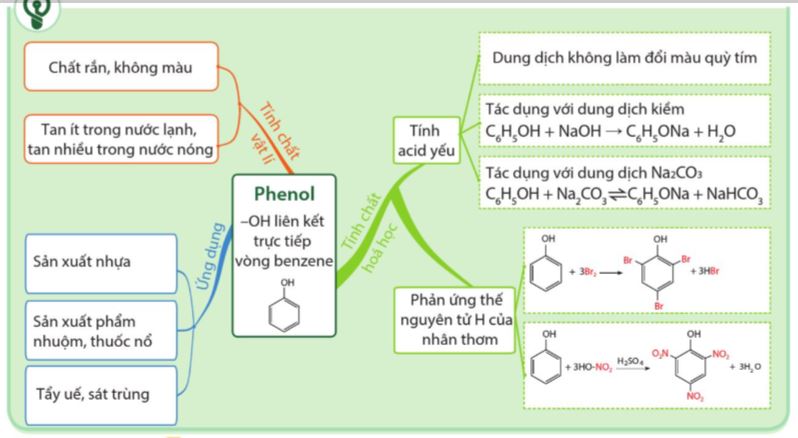
1.2. Tính chất vật lí
Hình 17.3. Phenol tinh khiết
– Ở điều kiện thường, phenol là chất rắn không màu, nóng chảy ở 43°C, sôi ở 181,8°C.
– Phenol dễ bị chảy rữa khi để trong không khí.
– Do có nhóm -OH trong phân tử nên phenol tạo ra liên kết hydrogen giữa các phân tử.
– Do vậy, phenol có nhiệt độ sốn và nhiệt độ nóng chảy cao hơn các aryl halide có phân tử khối tương đương.
– Phenol ít tan trong nước ở điều kiện thường (độ tan trong nước ở 25°C: 8,42 g/100 g nước), tan nhiều khi đun nóng (tan vô hạn ở 66°C); tan tốt trong các dung môi hữu cơ như ethanol, ether và acetone.
Hình 17.4. Liên kết hydrogen giữa các phân tử phenol (a) và giữa phân tử phenol với nước (b)
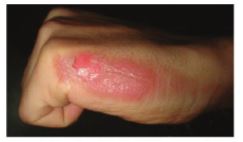
– Phenol độc và có thể gây bỏng khi tiếp xúc với da nên phải cần thận khi sử dụng.
Hình 17.5. Bàn tay bị bỏng do tiếp xúc với phenol
1.3. Tính chất hoá học
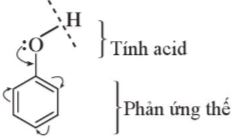
- Trong phân tử phenol, nhóm –OH liên kết trực tiếp với vòng benzene.
- Chính nhờ có sự liên kết này, vòng benzene trở thành nhóm hút electron, làm giảm mật độ electron ở nguyên tử oxygen và tăng sự phân cực của liên kết O-H (so với trong phân tử alcohol); đồng thời làm tăng mật độ electron trong vòng benzene, nhất là ở các vị trí ortho và para.
Hình 17.6. Ảnh hưởng qua lại giữa nhóm OH và vòng benzene
a. Tính acid của phenol
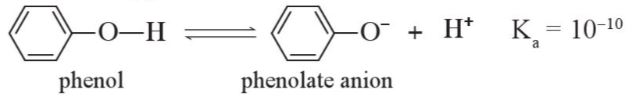
– Trong dung dịch nước, phenol phân li theo cân bằng sau:
|
Phenol là một acid yếu, dung dịch phenol không làm đổi màu quỳ tím. |
– Phenol có thể phản ứng được với kim loại kiềm, dung dịch base, muối sodium carbonate,... Ví dụ:
Ví dụ:
C6H5OH + NaOH → C6H5ONa + H2O
C6H5OH + Na2CO3 \(\rightleftharpoons\) C6H5ONa+ NaHCO3 (1)
(1) Phenol có tính acid mạnh hơn nấc hai của carbonic acid (H2CO3) nên có thể phản ứng được với muối carbonate.
b. Phản ứng thế nguyên tử H của vòng thơm
|
Phenol có thể tham gia phản ứng thế nguyên tử hydrogen của vòng benzene. Phản ứng thế ưu tiên vào vị trí 2, 4 và 6 (ortho và para). |
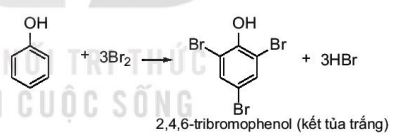
Phản ứng với nước bromine
|
Phenol phản ứng với nước bromine tạo sản phẩm thế 2,4,6–tribromophenol kết tủa màu trắng. |
– Do ảnh hưởng của nhóm –OH, phản ứng thế nguyên tử hydrogen ở vòng benzene của phenol xảy ra dễ dàng hơn so với benzene.
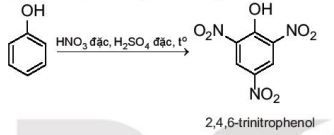
Phản ứng với dung dịch HNO3 đặc
|
Phenol phản ứng với dung dịch nitric acid đặc trong dung dịch sulfuric acid đặc tạo thành sản phẩm 2,4,6–trinitrophenol (picric acid): |
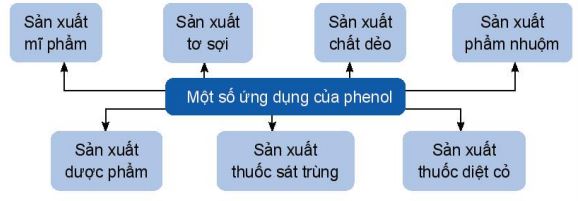
1.4. Ứng dụng và điều chế
a. Ứng dụng
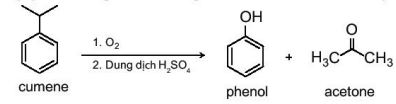
b. Điều chế
|
Phenol được tổng hợp từ cumene (isopropylbenzene) bằng phản ứng oxi hoá bởi oxygen rồi thuỷ phân trong môi trường acid thu được hai sản phẩm là phenol và acetone |
–Hiện nay, phần lớn phenol và acetone đều được sản xuất trong công nghiệp theo phương pháp này.
– Ngoài ra, phenol còn được điều chế từ nhựa than đá.
Bài tập minh họa
Bài 1. Ảnh hưởng của nhóm OH đến nhân benzene được chứng minh bởi phản ứng nào?
A. Phản ứng của phenol với dung dịch NaOH.
B. Phản ứng của phenol với nước bromine.
C. Phản ứng của phenol với Na.
D. Phản ứng của phenol với andehyde formic.
Hướng dẫn giải
Ảnh hưởng của nhóm –OH đến nhân benzene : Nhóm –OH đẩy e vào vòng benzene làm cho mật độ điện tích âm tại vị trí o, p tăng, các tác nhân thế mang điện tích dương như Br+, NO2+ dễ tấn công vào o, p.
Chọn phản ứng với dung dịch Br2
Bài 2. Vì sao phenol có lực acid mạnh hơn ancol và phản ứng thế vào nhân thơm ở phenol dễ hơn ở benzene?
A. Do phenol có phân tử khối lớn hơn
B. Do ảnh hưởng qua lại giữa gốc phenyl và nhóm OH
C. Do liên kết hydrogen
D. Cả A và C
Hướng dẫn giải
- Đó là do ảnh hưởng qua lại giữa gốc phenyl và nhóm hidroxyl như sau:
Cặp electron chưa tham gia liên kết của nguyên tử oxygen do ở cách các electron \(\pi\) của vòng benzene chỉ một liên kết \(\sigma\) làm cho mật độ electron dịch chuyển vào vòng benzene. Điều đó dẫn tới các hệ quả sau:
+ Liên kết O−H trở nên phân cực hơn, làm cho nguyên tử H linh động hơn. Tính acid mạnh hơn alcohol.
+ Mật độ electron ở vòng benzene tăng lên, nhất là ở các vị trí o và p, làm cho phản ứng thế dễ dàng hơn so với benzene và đồng đẳng của nó.
+ Liên kết C−O trở nên bền vững so với ở alcohol, vì thế nhóm OH phenol không bị thế bởi gốc acid như nhóm OH alcohol.
⇒ Chọn B
Luyện tập Bài 17 Hóa 11 Cánh Diều
Học xong bài học này, em có thể:
– Nêu được khái niệm về phenol, tên gọi, công thức cấu tạo một số phenol đơn giản, đặc điểm cấu tạo và hình dạng phân tử của phenol.
– Nêu được tính chất vật lí của phenol.
– Trình bày được tính chất hoá học cơ bản; giải thích được tính chất hoá học; ứng dụng và điều chế phenol.
3.1. Trắc nghiệm Bài 17 Hóa 11 Cánh Diều
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 11 CD Bài 17 cực hay có đáp án và lời giải chi tiết.
-
- A. Phản ứng của phenol với dung dịch NaOH
- B. Phản ứng của phenol với nước Bromine
- C. Phản ứng của phenol với Na
- D. Phản ứng của phenol với formandehyde
-
Câu 2:
Nhận xét nào sau đây đúng?
- A. Phenol có tính acid mạnh hơn ethanol
- B. Phenol có tính acid yếu hơn ethanol
- C. Phenol dễ tan trong nước hơn trong dung dịch NaOH
- D. Phenol không có tính acid
-
- A. C7H8O
- B. C7H8O2
- C. C8H10O
- D. C8H10O2
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 17 Hóa 11 Cánh Diều
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 11 CD Bài 17 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Mở đầu trang 116 SGK Hóa học 11 Cánh diều – CD
Luyện tập 1 trang 118 SGK Hóa học 11 Cánh diều – CD
Giải Câu hỏi 1 trang 118 SGK Hóa học 11 Cánh diều – CD
Luyện tập 2 trang 118 SGK Hóa học 11 Cánh diều – CD
Thí nghiệm 1 trang 119 SGK Hóa học 11 Cánh diều – CD
Thí nghiệm 2 trang 119 SGK Hóa học 11 Cánh diều – CD
Luyện tập 3 trang 119 SGK Hóa học 11 Cánh diều – CD
Thí nghiệm 3 trang 119 SGK Hóa học 11 Cánh diều – CD
Luyện tập 4 trang 119 SGK Hóa học 11 Cánh diều – CD
Thí nghiệm 4 trang 120 SGK Hóa học 11 Cánh diều – CD
Giải Câu hỏi 2 trang 120 SGK Hóa học 11 Cánh diều – CD
Giải Bài 1 trang 121 SGK Hóa học 11 Cánh diều – CD
Giải Bài 2 trang 121 SGK Hóa học 11 Cánh diều – CD
Giải Bài 3 trang 121 SGK Hóa học 11 Cánh diều – CD
Giải Bài 4 trang 121 SGK Hóa học 11 Cánh diều – CD
Hỏi đáp Bài 17 Hóa 11 Cánh Diều
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!



%20v%C3%A0%20gi%E1%BB%AFa%20ph%C3%A2n%20t%E1%BB%AD%20phenol%20v%E1%BB%9Bi%20n%C6%B0%E1%BB%9Bc%20(b).JPG)
.JPG)