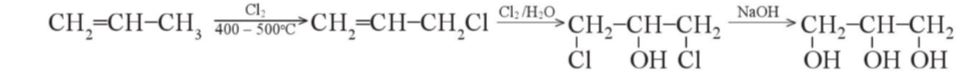Một số loài thực vật như tràm, bạc hà, hoa hồng, ... thường có mùi thơm dễ chịu và đặc trưng, vì trong thành phần hoá học có chứa hợp chất menthol, terpinen-4-ol hoặc geraniol, ... là các alcohol. Alcohol là gì?
Hãy cùng HOC247 tìm hiểu nội dung lý thuyết và bài tập của Bài 16 Alcohol trong chương trình môn Hóa học lớp 11 Cánh diều để hiểu rõ hơn về khái niệm, danh pháp của alcohol, đặc điểm cấu tạo, tính chất vật lí, hoá học, ứng dụng và phương pháp điều chế alcohol nhé!
Tóm tắt lý thuyết
1.1. Khái niệm và danh pháp
a. Khái niệm
|
Alcohol là những hợp chất hữu cơ trong phân tử có chứa nhóm hydroxy (–OH) liên kết với nguyên tử carbon no. |
- Alcohol có nhóm hydroxy liên kết với gốc hydrocarbon no được gọi là alcohol no, với gốc hydrocarbon không no được gọi là alcohol không no, với gốc hydrocarbon thơm được gọi là alcohol thơm.
Ví dụ:
- Alcohol no, đơn chức, mạch hở trong phân tử có một nhóm –OH liên kết với gốc alkyl, có công thức tổng quát là CnH2n+1OH (n ≥ 1).
Ví dụ:
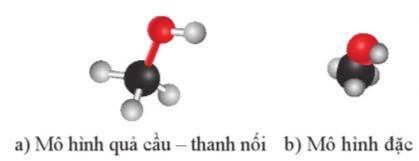
Hình 16.1. Mô hình phân tử methyl alcohol
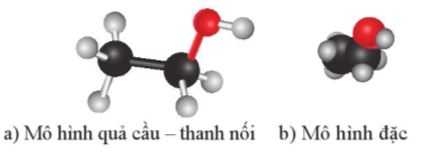
Hình 16.2. Mô hình phân tử ethyl alcohol
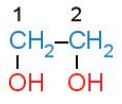
- Nếu alcohol có hai hay nhiều nhóm –OH thì các alcohol đó được gọi là các alcohol đa chức (polyalcohol).
Ví dụ:
|
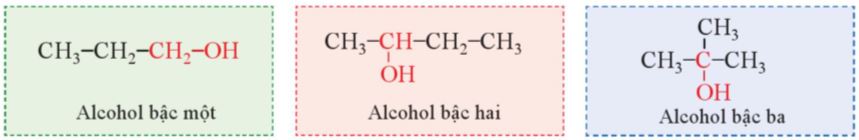
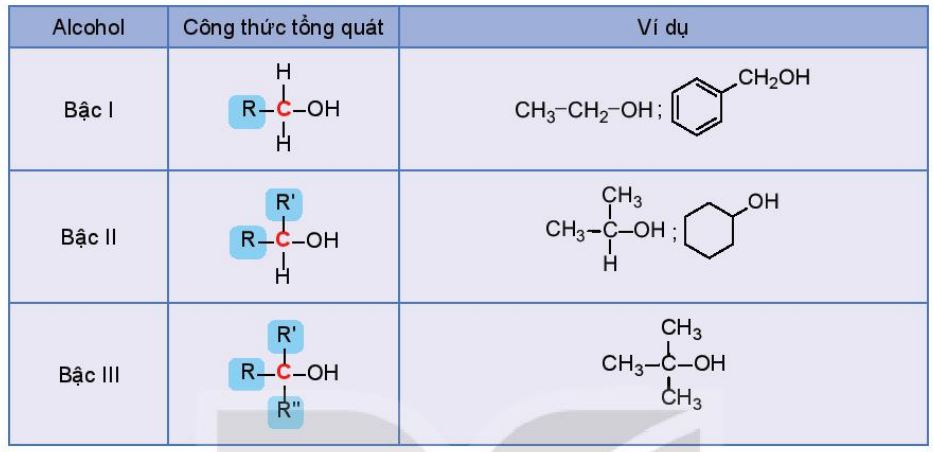
Bậc của alcohol là bậc của nguyên tử carbon liên kết với nhóm hydroxy. Ta có alcohol bậc I, alcohol bậc II và alcohol bậc III. |
Ví dụ:
Bảng 16.1. Bậc của alcohol
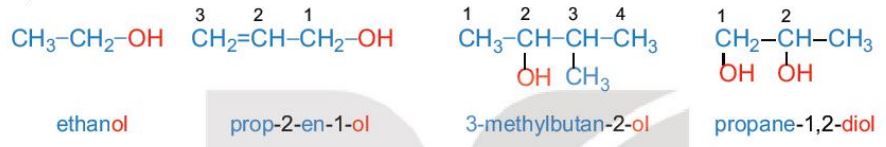
b. Danh pháp
- Tên thông thường của một số alcohol thường gặp:
- Các alcohol no, đơn chức, mạch hở trong phân tử có từ 3 nguyên tử carbon trở lên có đồng phân vị trí nhóm -OH, có từ 4 nguyên tử carbon trở lên có thêm đồng phân mạch carbon.
- Tên theo danh pháp thay thế của alcohol đơn chức:
- Tên theo danh pháp thay thế của alcohol đa chức:
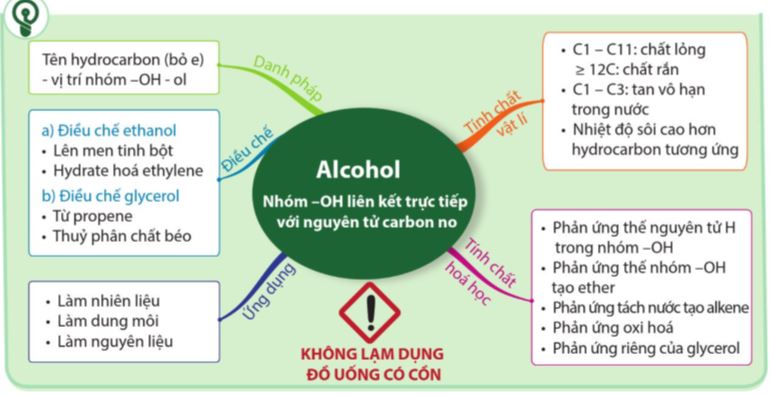
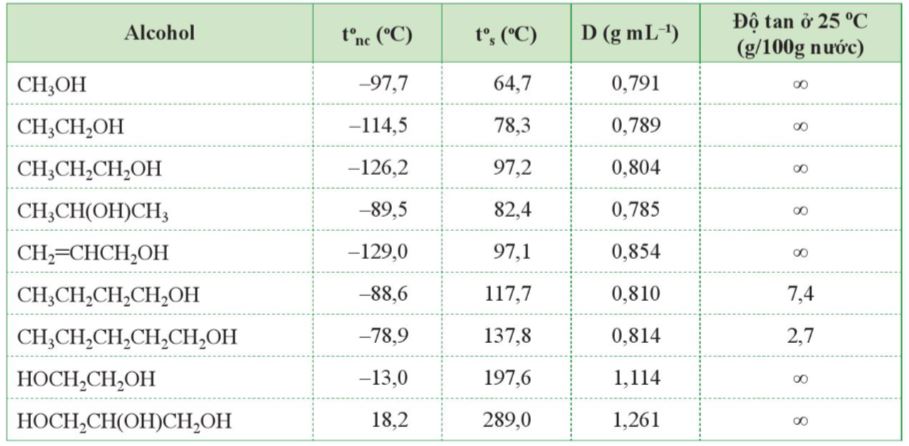
1.2. Tính chất vật lí
- Ở điều kiện thường, các alcohol no, đơn chức từ C1 đến C12 ở trạng thái lỏng, các alcohol từ C13 trở lên ở trạng thái rắn.
- Các polyalcohol như ethylene glycol, glycerol là chất lỏng sánh, nặng hơn nước và có vị ngọt.
- Alcohol có nhiệt độ sôi cao hơn các hydrocarbon, dẫn xuất halogen có phân tử khối tương đương và dễ tan trong nước do các phân tử alcohol có thể tạo liên kết hydrogen với nhau và với nước.
Hình 16.3. Liên kết hydrogen giữa các phân tử ethanol (a) và giữa ethanol với nước (b)
- Khi số nguyên tử carbon trong phân tử tăng lên, độ tan trong nước của alcohol giảm nhanh do gốc hydrocarbon là phần kị nước tăng lên.
Bảng 16.2. Một số tính chất vật lí của alcohol
1.3. Tính chất hoá học
Hình 16.3. Sự phân cực của liên kết C–O và O-H trong phân tử alcohol
|
Trong phân tử alcohol, liên kết C-O và O-H phân cực về phía nguyên tử oxygen, 2 liên kết này quyết định các tính chất hoá học của alcohol |
a. Phản ứng thế nguyên tử hydrogen trong nhóm –OH
Liên kết O-H phân cực mạnh về phía oxygen nên nguyên tử hydrogen của nhóm -OH dễ tách ra khỏi phân tử alcohol trong một số phản ứng hoá học, như phản ứng với kim loại kiềm.
b. Phản ứng thế nhóm -OH tạo thành ether
- Hai phân tử ethyl alcohol có thể tạo thành diethyl ether nhờ xúc tác dung dịch H2SO4 đặc, đun nóng.
- Khi đun các alcohol khác với dung dịch H2SO4 đặc ở nhiệt độ thích hợp cũng thu được ether.
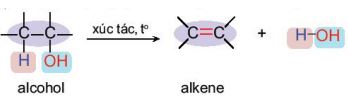
c. Phản ứng tách H2O tạo thành alkene
- Dẫn hơi ethanol qua ống sứ chứa bột A2O3 nung nóng hoặc đun ethanol với H2SO4 đặc ở khoảng 170°C, sẽ tạo thành ethene.
C2H5OH \(\xrightarrow{{{H}_{2}}S{{O}_{4}}\,đặc,\ {{180}^{0}}C}\) CH2=CH2 + H2O
- Khi alcohol có 2 hoặc 3 vị trí nguyên tử hydrogen tách với nhóm OH, sự tách nước tuân theo quy tắc Zaitsev.
|
Phản ứng tách nước từ alkanol tạo ra alkene: |
d. Phản ứng oxi hoá
|
Phản ứng oxi hoá hoàn toàn: Alcohol + oxygen \(\xrightarrow{{{t}^{o}}}\) carbonic + nước |
Ví dụ:
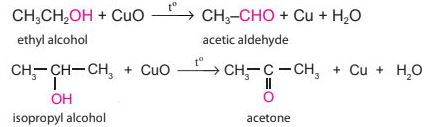
|
Phản ứng oxi hoá không hoàn toàn: |
Ví dụ:
e. Phản ứng riêng của polyalcohol
|
Các polyalcohol có các nhóm –OH liền kề như ethylene glycol, glycerol, ... có thể tạo phức chất với Cu(OH)2, sản phẩm có màu xanh đặc trưng. |
Ví dụ:
1.4. Ứng dụng và điều chế
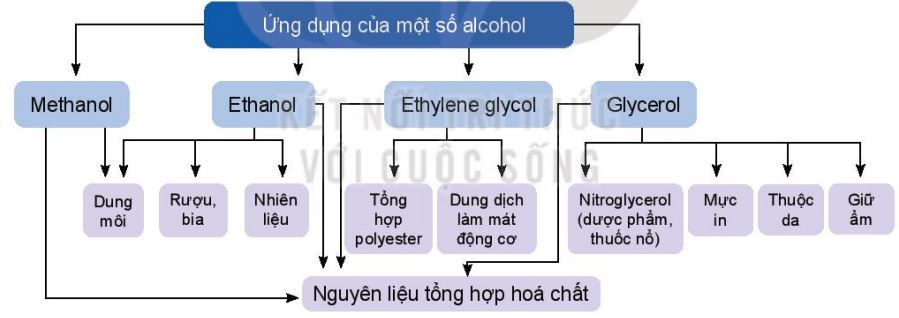
a. Ứng dụng
- Nhiều alcohol được ứng dụng rộng rãi trong các lĩnh vực: đồ uống, dược phẩm, mĩ phẩm, y tế, phẩm nhuộm hoặc làm nhiên liệu, ...
- Lạm dụng đồ uống có cồn sẽ gây hại cho sức khoẻ, gây tai nạn khi tham gia giao thông.
b. Điều chế
Hydrate hoá alkene
|
Các alcohol có thể được điều chế bằng phản ứng hydrate hoá alkene. Phương pháp này được sử dụng phổ biến trong công nghiệp để điều chế ethanol CH2=CH2 + H2O \(\xrightarrow{{{H}_{3}}P{{O}_{4}},\ {{t}^{0}}}\) C2H5OH |
Điều chế ethanol bằng phương pháp sinh hoá
- Khi lên men tinh bột, enzyme sẽ phân giải tinh bột (C6H10O5)n thành glucose C6H12O6, sau đó glucose sẽ chuyển hoá thành ethanol C2H5OH:
(C6H10O5)n + nH2O \(\xrightarrow{enzyme}\) nC6H12O6
C6H12O6 \(\xrightarrow{enzyme}\) 2C2H5OH + 2CO2
- Ngoài các sản phẩm chứa tinh bột (gạo, ngô, sắn,...), người ta còn sử dụng các phế phẩm của công nghiệp đường, chế phẩm thuỷ phân cellulose,... để sản xuất ethanol.
- Phương pháp sinh hoá được sử dụng phổ biến để sản xuất các đồ uống có cồn, điều chế ethanol làm nhiên liệu sinh học.
Điều chế glycerol
- Trong công nghiệp, glycerol được tổng hợp từ propylene theo sơ đồ sau:
- Ngoài ra, glycerol còn thu được khi thuỷ phân chất béo trong quá trình sản xuất xà phòng.
Bài tập minh họa
Bài 1. Phản ứng nào sau đây không xảy ra:
A. C2H5OH + CH3COOH
B. C2H5OH + HBr
C. C2H5OH + O2
D. C2H5OH + NaOH
Hướng dẫn giải
A. C2H5OH + CH3COOH \(\rightleftharpoons\) CH3COOC2H5 + H2O
B. C2H5OH + HBr → C2H5Br + H2O
C. C2H5OH + 3O2 \(\xrightarrow{{{t}^{o}}}\) 2CO2 + 3H2O
D. C2H5OH + NaOH
C2H5OH không phản ứng với NaOH.
Bài 2. Cho các chất sau : ethanol, glycerol, ethylene glycol. Chất không hòa tan được Cu(OH)2 ở nhiệt độ phòng là
A. ethylene glycol.
B. glycerol
C. ethanol.
D. ethanol và ethylene glycol.
Hướng dẫn giải
Ethanol không hoà tan được Cu(OH)2 ở nhiệt độ phòng
Các polyalcohol có các nhóm –OH liền kề như ethylene glycol, glycerol, ... có thể tạo phức chất với Cu(OH)2, sản phẩm có màu xanh đặc trưng.
Luyện tập Bài 16 Hóa 11 Cánh Diều
Học xong bài học này, em có thể:
- Nêu được khái niệm alcohol; đặc điểm liên kết và hình dạng phân tử của methanol, ethanol.
- Viết được công thức cấu tạo, gọi tên theo danh pháp thay thế một số alcohol đơn giản, tên thông thường của một vài alcohol thường gặp.
- Trình bày được đặc điểm về tính chất vật lí; tính chất hoá học; ứng dụng của alcohol và phương pháp điều chế ethanol.
3.1. Trắc nghiệm Bài 16 Hóa 11 Cánh Diều
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 11 CD Bài 16 cực hay có đáp án và lời giải chi tiết.
-
- A. H2SO4 đặc, 120oC
- B. H2SO4 loãng, 140oC
- C. H2SO4 đặc, 170oC
- D. H2SO4 đặc, 140oC
-
- A. C2H5OH
- B. C3H5OH
- C. CH3OH
- D. C3H7OH
-
- A. methanol
- B. ethanol
- C. ethylene glycol
- D. glycerol
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 16 Hóa 11 Cánh Diều
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 11 CD Bài 16 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Mở đầu trang 107 SGK Hóa học 11 Cánh diều – CD
Giải Câu hỏi 1 trang 108 SGK Hóa học 11 Cánh diều – CD
Luyện tập 1 trang 109 SGK Hóa học 11 Cánh diều – CD
Luyện tập 2 trang 109 SGK Hóa học 11 Cánh diều – CD
Luyện tập 3 trang 110 SGK Hóa học 11 Cánh diều – CD
Luyện tập 4 trang 110 SGK Hóa học 11 Cánh diều – CD
Luyện tập 5 trang 111 SGK Hóa học 11 Cánh diều – CD
Luyện tập 6 trang 111 SGK Hóa học 11 Cánh diều – CD
Thí nghiệm 1 trang 111 SGK Hóa học 11 Cánh diều – CD
Giải Câu hỏi 2 trang 112 SGK Hóa học 11 Cánh diều – CD
Thí nghiệm 2 trang 112 SGK Hóa học 11 Cánh diều – CD
Luyện tập 7 trang 112 SGK Hóa học 11 Cánh diều – CD
Giải Câu hỏi 3 trang 113 SGK Hóa học 11 Cánh diều – CD
Vận dụng 1 trang 113 SGK Hóa học 11 Cánh diều – CD
Vận dụng 2 trang 114 SGK Hóa học 11 Cánh diều – CD
Vận dụng 3 trang 114 SGK Hóa học 11 Cánh diều – CD
Luyện tập 8 trang 114 SGK Hóa học 11 Cánh diều – CD
Giải Bài 1 trang 115 SGK Hóa học 11 Cánh diều – CD
Giải Bài 2 trang 115 SGK Hóa học 11 Cánh diều – CD
Giải Bài 3 trang 115 SGK Hóa học 11 Cánh diều – CD
Hỏi đáp Bài 16 Hóa 11 Cánh Diều
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!


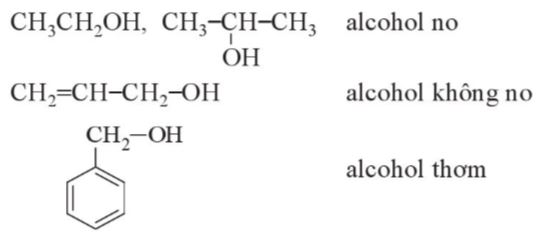



%20v%C3%A0%20gi%E1%BB%AFa%20ethanol%20v%E1%BB%9Bi%20n%C6%B0%E1%BB%9Bc%20(b).JPG)







2.JPG)
%20hydroxide%20v%C3%B3i%20glycerol.JPG)