Kh├Ł thi├¬n nhi├¬n, kh├Ł dß║¦u mß╗Å, x─āng, nhi├¬n liß╗ću phß║Żn lß╗▒c v├Ā dß║¦u diesel c├│ vai tr├▓ rß║źt quan trß╗Źng trong mß╗Źi l─®nh vß╗▒c cß╗¦a ─æß╗Øi sß╗æng, kinh tß║┐, c├┤ng nghiß╗ćp. Vß║Ły th├Ānh phß║¦n ch├Łnh cß╗¦a c├Īc nhi├¬n liß╗ću n├Āy l├Ā g├¼?
Ch├║ng ta h├Ży c├╣ng t├¼m hiß╗āu th├┤ng qua b├Āi giß║Żng v├Ā b├Āi tß║Łp B├Āi 12: Alkane m├┤n Ho├Ī hß╗Źc 11 C├Īnh diß╗üu, nß╗Öi dung b├Āi hß╗Źc ─æ├Ż ─æŲ░ß╗Żc HOC247 t├│m tß║»t ngß║»n gß╗Źn, chi tiß║┐t v├Ā ─æß║¦y ─æß╗¦ c├Īc kiß║┐n thß╗®c quan trß╗Źng.
Hi vß╗Źng b├Āi giß║Żng sß║Į gi├║p c├Īc em ─æß║Īt ─æŲ░ß╗Żc nhiß╗üu kiß║┐n thß╗®c bß╗Ģ ├Łch.
T├│m tß║»t l├Į thuyß║┐t
1.1. Kh├Īi niß╗ćm v├Ā danh ph├Īp
a. Kh├Īi niß╗ćm
| Alkane l├Ā c├Īc hydrocarbon no mß║Īch hß╗¤ chß╗ē chß╗®a li├¬n kß║┐t ─æŲĪn (li├¬n kß║┐t \(\sigma \)) CŌĆöH v├Ā CŌĆöC trong ph├ón tß╗Ł. |
ŌłÆ C├┤ng thß╗®c chung cß╗¦a alkane: CnH2n+2 (n l├Ā sß╗æ nguy├¬n, n Ōēź 1).
V├Ł dß╗ź: CH4 C2H6 C3H8, C4H10, C5H12...
H├¼nh 12.1. M├┤ h├¼nh ph├ón tß╗Ł cß╗¦a methane (a) v├Ā ethane (b)
- Mß╗Śi nguy├¬n tß╗Ł carbon trong ph├ón tß╗Ł alkane nß║▒m ß╗¤ t├óm mß╗Öt h├¼nh tß╗® diß╗ćn, li├¬n kß║┐t vß╗øi bß╗æn nguy├¬n tß╗Ł (hay nh├│m nguy├¬n tß╗Ł) nß║▒m ß╗¤ bß╗æn ─æß╗ēnh cß╗¦a h├¼nh tß╗® diß╗ćn ─æ├│.
b. ─Éß╗ōng ph├ón
| C├Īc alkane c├│ tß╗½ bß╗æn nguy├¬n tß╗Ł C trß╗¤ l├¬n c├│ ─æß╗ōng ph├ón vß╗ü mß║Īch carbon. |
V├Ł dß╗ź:
c. Danh ph├Īp
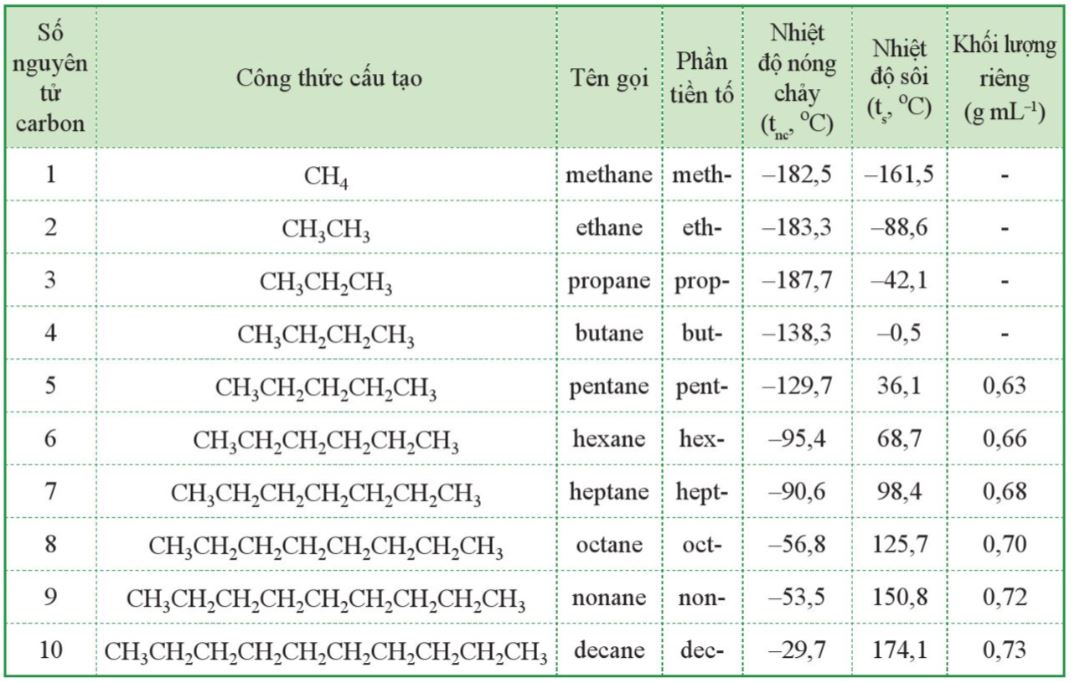
- T├¬n cß╗¦a 10 alkane mß║Īch kh├┤ng ph├ón nh├Īnh ─æß║¦u ti├¬n trong d├Ży ─æß╗ōng ─æß║│ng v├Ā phß║¦n tiß╗ün tß╗æ cho biß║┐t sß╗æ lŲ░ß╗Żng nguy├¬n tß╗Ł carbon trong mß║Īch carbon ─æŲ░ß╗Żc giß╗øi thiß╗ću ß╗¤ Bß║Żng 12.1.
Ch├║ ├Į: phß║¦n tiß╗ün tß╗æ cho biß║┐t sß╗æ lŲ░ß╗Żng nguy├¬n tß╗Ł carbon c┼®ng ─æŲ░ß╗Żc sß╗Ł dß╗źng chung cho c├Īc loß║Īi hß╗Żp chß║źt hß╗»u cŲĪ kh├Īc c├│ c├╣ng sß╗æ lŲ░ß╗Żng nguy├¬n tß╗Ł carbon.
Bß║Żng 12.1. T├¬n cß╗¦a alkane, phß║¦n tiß╗ün tß╗Ģ ß╗®ng vß╗øi sß╗æ nguy├¬n tß╗Ł carbon v├Ā mß╗Öt sß╗æ t├Łnh chß║źt vß║Łt l├Ł cß╗¦a mß╗Öt sß╗æ alkane
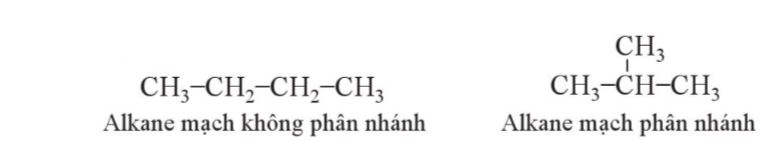
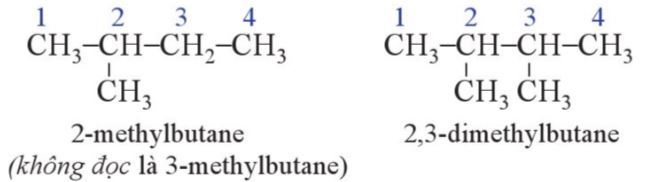
- Vß╗øi alkane mß║Īch ph├ón nh├Īnh, mß║Īch carbon d├Āi nhß║źt l├Ā mß║Īch ch├Łnh; c├Īc mß║Īch carbon c├▓n lß║Īi l├Ā mß║Īch nh├Īnh.
- Mß║Īch nh├Īnh c├▓n ─æŲ░ß╗Żc xem l├Ā nh├│m thß║┐ alkyl cß╗¦a mß║Īch ch├Łnh.
- ─É├Īnh sß╗æ c├Īc nguy├¬n tß╗Ł carbon tr├¬n mß║Īch ch├Łnh xuß║źt ph├Īt tß╗½ ─æß║¦u gß║¦n mß║Īch nh├Īnh nhß║źt ─æß╗ā tß╗Ģng sß╗æ chß╗ē vß╗ŗ tr├Ł cß╗¦a c├Īc nh├Īnh l├Ā nhß╗Å nhß║źt.
- Khi ─æ├│, t├¬n cß╗¦a alkane mß║Īch ph├ón nh├Īnh ─æŲ░ß╗Żc gß╗Źi nhŲ░ sau:
- T├¬n cß╗¦a nh├│m thß║┐ alkyl ─æŲ░ß╗Żc h├¼nh th├Ānh bß║▒ng c├Īch th├¬m -yl v├Āo sau phß║¦n tiß╗ün tß╗Ģ chß╗ē sß╗æ nguy├¬n tß╗Ł carbon c├│ trong nh├│m thß║┐.
- Nß║┐u c├│ nhiß╗üu nh├│m thß║┐ giß╗æng nhau th├¼ th├¬m ŌĆ£diŌĆØ (nß║┐u c├│ 2 nh├│m thß║┐), ŌĆ£tr├ŁŌĆØ (nß║┐u c├│ 3 nh├│m), ŌĆ£tetraŌĆØ (nß║┐u c├│ 4 nh├│m),... v├Āo trŲ░ß╗øc t├¬n gß╗Źi cß╗¦a nh├│m thß║┐.
V├Ł dß╗ź:
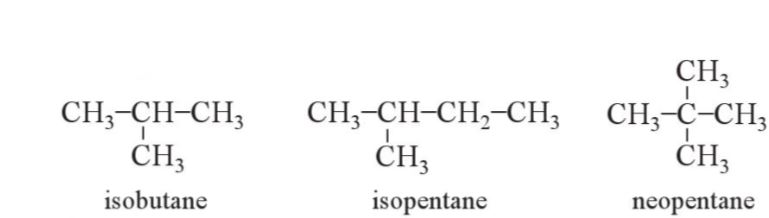
- Một số alkane có tên riêng.
V├Ł dß╗ź:
1.2. T├Łnh chß║źt vß║Łt l├Ł
- ß╗× ─æiß╗üu kiß╗ćn thŲ░ß╗Øng, alkane tß╗½ C1 ─æß║┐n C4 v├Ā neopentane ß╗¤ trß║Īng th├Īi kh├Ł, tß╗½ C5 ─æß║┐n C17 (trß╗½ neopentane) ß╗¤ trß║Īng th├Īi lß╗Ång, kh├┤ng m├Āu, alkane tß╗½ C18 trß╗¤ l├¬n l├Ā chß║źt rß║»n m├Āu trß║»ng (c├▓n gß╗Źi l├Ā s├Īp paraffin).
- C├Īc alkane mß║Īch nh├Īnh thŲ░ß╗Øng c├│ nhiß╗ćt ─æß╗Ö s├┤i thß║źp hŲĪn so vß╗øi ─æß╗ōng ph├ón alkane mß║Īch kh├┤ng ph├ón nh├Īnh.
- Alkane kh├┤ng tan hoß║Ęc tan rß║źt ├Łt trong nŲ░ß╗øc v├Ā nhß║╣ hŲĪn nŲ░ß╗øc.
- Alkane thuß╗Öc loß║Īi hß╗Żp chß║źt hß╗»u cŲĪ k├®m ph├ón cß╗▒c n├¬n ─æß╗üu tan k├®m trong nŲ░ß╗øc, tan tß╗æt hŲĪn trong c├Īc dung m├┤i hß╗»u cŲĪ.
- Mß╗Öt sß╗æ t├Łnh chß║źt vß║Łt l├Ł cß╗¦a alkane ─æŲ░ß╗Żc m├┤ tß║Ż ß╗¤ Bß║Żng 12.1.
1.3. T├Łnh chß║źt ho├Ī hß╗Źc
- Do ph├ón tß╗Ł chß╗ē chß╗®a li├¬n kß║┐t \(\sigma\) bß╗ün, k├®m ph├ón cß╗▒c, mß╗Śi nguy├¬n tß╗Ł carbon c┼®ng nhŲ░ hydrogen ─æ├Ż tß║Īo ra sß╗æ li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ lß╗øn nhß║źt cß╗¦a ch├║ng.
- V├¼ thß║┐, alkane tŲ░ŲĪng ─æß╗æi trŲĪ vß╗ü mß║Ęt ho├Ī hß╗Źc v├Ā phß║Żn ß╗®ng ho├Ī hß╗Źc xß║Ży ra sß║Į k├©m theo viß╗ćc thay thß║┐ nguy├¬n tß╗Ł hydrogen hoß║Ęc bß║╗ g├Ży mß║Īch carbon.
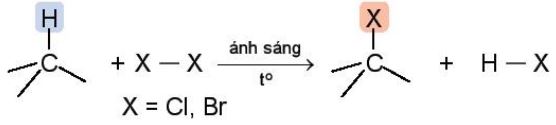
a. Phß║Żn ß╗®ng thß║┐
|
Phß║Żn ß╗®ng thß║┐ nguy├¬n tß╗Ł hydrogen trong alkane bß║▒ng nguy├¬n tß╗Ł halogen chß╗ē xß║Ży ra khi ─æun n├│ng hoß║Ęc chiß║┐u ├Īnh s├Īng |
- Phß║Żn ß╗®ng tr├¬n ─æŲ░ß╗Żc gß╗Źi l├Ā phß║Żn ß╗®ng halogen ho├Ī alkane. Sß║Żn phß║®m cß╗¦a phß║Żn ß╗®ng halogen ho├Ī l├Ā c├Īc dß║½n xuß║źt halogen.
V├Ł dß╗ź:
- Khi trß╗Ön methane vß╗øi chlorine v├Ā chiß║┐u ├Īnh s├Īng tß╗Ł ngoß║Īi, sß║Żn phß║®m thu ─æŲ░ß╗Żc l├Ā chloromethane.
CH4 + Cl2 \(\xrightarrow{├Īnh\,s├Īng}\) CH3Cl + HCl
- Phß║Żn ß╗®ng thß║┐ c├│ thß╗ā tiß║┐p tß╗źc diß╗ģn ra vß╗øi c├Īc nguy├¬n tß╗Ł hydrogen c├▓n lß║Īi cß╗¦a chloromethane cho hß╗Śn hß╗Żp c├Īc sß║Żn phß║®m chloromethane, dichloromethane, trichloromethane v├Ā tetrachloromethane.
CH3Cl + Cl2 \(\xrightarrow{├Īnh\,s├Īng}\) CH2Cl2 + HCl
CH2Cl2 + Cl2 \(\xrightarrow{├Īnh\,s├Īng}\) CHCl3 + HCl
CHCl3 + Cl2 \(\xrightarrow{├Īnh\,s├Īng}\) CCl4 + HCl
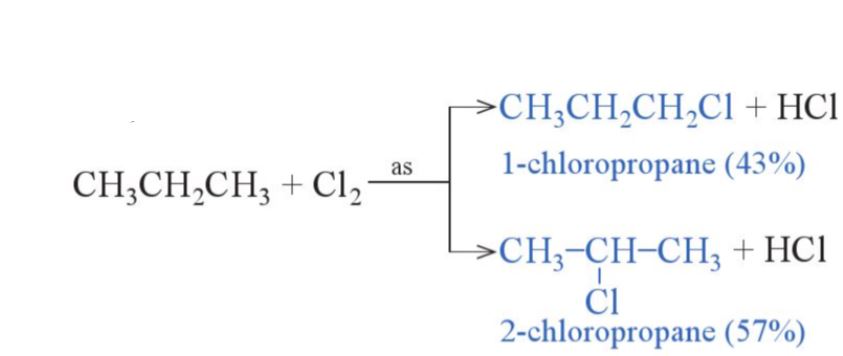
- Khi thß╗▒c hiß╗ćn phß║Żn ß╗®ng thß║┐ halogen v├Āo c├Īc alkane c├│ tß╗½ 3 nguy├¬n tß╗Ł carbon trß╗¤ l├¬n sß║Į thu ─æŲ░ß╗Żc ─æŲ░ß╗Żc hß╗Śn hß╗Żp c├Īc sß║Żn phß║®m thß║┐ monohalogen.
V├Ł dß╗ź:
|
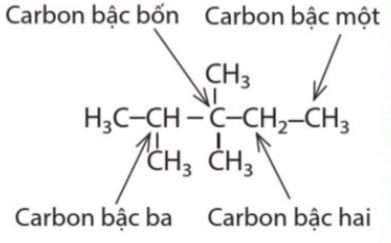
Bß║Łc cß╗¦a nguy├¬n tß╗Ł carbon trong ph├ón tß╗Ł chß║źt hß╗»u cŲĪ ─æŲ░ß╗Żc x├Īc ─æß╗ŗnh bß║▒ng sß╗æ li├¬n kß║┐t giß╗»a nguy├¬n tß╗Ł carbon ─æ├│ vß╗øi c├Īc nguy├¬n tß╗Ł carbon kh├Īc ß╗¤ xung quanh. |
b. Phß║Żn ß╗®ng cracking v├Ā phß║Żn Ų░ng reforming
|
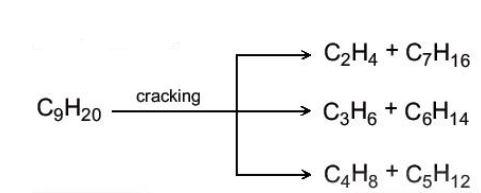
Cracking alkane l├Ā qu├Ī tr├¼nh ph├ón cß║»t li├¬n kß║┐t CŌĆōC (bß║╗ g├Ży mß║Īch carbon) cß╗¦a c├Īc alkane mß║Īch d├Āi ─æß╗ā tß║Īo th├Ānh hß╗Śn hß╗Żp c├Īc hydrocarbon c├│ mß║Īch carbon ngß║»n hŲĪn. |
- Phß║Żn ß╗®ng cracking ─æŲ░ß╗Żc thß╗▒c hiß╗ćn trong ─æiß╗üu kiß╗ćn nhiß╗ćt ─æß╗Ö cao v├Ā thŲ░ß╗Øng c├│ x├║c t├Īc v├Ā ─æŲ░ß╗Żc ß╗®ng dß╗źng trong c├┤ng nghiß╗ćp lß╗Źc dß║¦u.
V├Ł dß╗ź: Cracking nonane C9H20, thu ─æŲ░ß╗Żc c├Īc alkane mß║Īch ngß║»n hŲĪn l├Ā C5 ŌĆō C7 v├Ā alkene C2 ŌĆō C4. SŲĪ ─æß╗ō phß║Żn ß╗®ng:
|
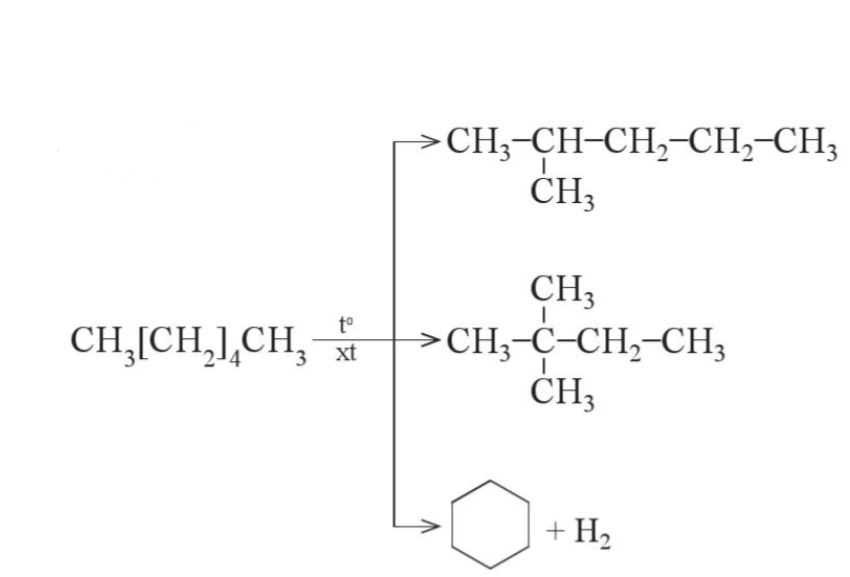
Reforming alkane l├Ā qu├Ī tr├¼nh chuyß╗ān c├Īc alkane mß║Īch kh├┤ng ph├ón nh├Īnh th├Ānh c├Īc alkane mß║Īch ph├ón nh├Īnh v├Ā c├Īc hydrocarbon mß║Īch v├▓ng nhŲ░ng kh├┤ng l├Ām thay ─æß╗Ģi sß╗æ nguy├¬n tß╗Ł carbon trong ph├ón tß╗Ł v├Ā c┼®ng kh├┤ng l├Ām thay ─æß╗Ģi ─æ├Īng kß╗ā nhiß╗ćt ─æß╗Ö s├┤i cß╗¦a ch├║ng. |
- Reforming alkane xß║Ży ra qu├Ī tr├¼nh ─æß╗ōng ph├ón ho├Ī (isomer ho├Ī) v├Ā arene ho├Ī (thŲĪm ho├Ī).
- Qu├Ī tr├¼nh reforming thŲ░ß╗Øng ─æŲ░ß╗Żc thß╗▒c hiß╗ćn vß╗øi c├Īc alkane C5 - C11 trong ─æiß╗üu kiß╗ćn nhiß╗ćt ─æß╗Ö cao v├Ā thŲ░ß╗Øng c├│ x├║c t├Īc.
V├Ł dß╗ź:
- Qu├Ī tr├¼nh reforming ─æŲ░ß╗Żc ß╗®ng dß╗źng trong c├┤ng nghiß╗ćp lß╗Źc dß║¦u ─æß╗ā l├Ām t─āng chß╗ē sß╗æ octane(1) cß╗¦a x─āng v├Ā sß║Żn xuß║źt c├Īc arene (benzene, toluene, xylene) l├Ām nguy├¬n liß╗ću cho c├┤ng nghiß╗ćp tß╗Ģng hß╗Żp hß╗»u cŲĪ.
(1) Chß╗ē sß╗æ octane (octane number) ─æß║Ęc trŲ░ng cho t├Łnh chß╗æng k├Łch nß╗Ģ cß╗¦a x─āng.
(2) Chß╗ē sß╗æ cetane (cetane number) ─æß║Ęc trŲ░ng cho khß║Ż n─āng tß╗▒ bß╗æc ch├Īy cß╗¦a nhi├¬n liß╗ću diesel.
c. Phß║Żn ß╗®ng oxi ho├Ī
Phß║Żn ß╗®ng oxi ho├Ī ho├Ān to├Ān (phß║Żn ß╗®ng ch├Īy)
- Khi tiß║┐p x├║c vß╗øi oxygen v├Ā c├│ tia lß╗Ła khŲĪi m├Āo, alkane bß╗ŗ ─æß╗æt ch├Īy tß║Īo th├Ānh kh├Ł carbon dioxide, hŲĪi nŲ░ß╗øc v├Ā giß║Żi ph├│ng n─āng lŲ░ß╗Żng.
|
\({{\text{C}}_{\text{n}}}{{\text{H}}_{\text{2n+2}}}\text{ +}\frac{\text{3n + 1}}{\text{2}}{{\text{O}}_{\text{2}}}\xrightarrow{{{t}^{0}}}\text{nC}{{\text{O}}_{\text{2}}}\text{+(n + 1)}{{\text{H}}_{\text{2}}}\text{O}\) |
V├Ł dß╗ź:
CH4(g) + 2O2(g) \(\xrightarrow{{{t}^{o}}}\) CO2(g) + 2H2O(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) = - 890 kJ/mol
C3H8(g) + 5O2(g) \(\xrightarrow{{{t}^{o}}}\) 3O2(g) + 4H2O(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) = - 2216 kJ/mol
- Phß║Żn ß╗®ng ch├Īy cß╗¦a alkane c├│ vai tr├▓ rß║źt quan trß╗Źng ─æß╗æi vß╗øi ─æß╗Øi sß╗æng con ngŲ░ß╗Øi.
- ─Éß╗æt ch├Īy c├Īc alkane cung cß║źp nhiß╗ćt ─æß╗ā ─æun nß║źu, sŲ░ß╗¤i ß║źm v├Ā cung cß║źp n─āng lŲ░ß╗Żng cho c├Īc ng├Ānh c├┤ng nghiß╗ćp.
Phß║Żn ß╗®ng oxi ho├Ī kh├┤ng ho├Ān to├Ān
- ß╗× nhiß╗ćt ─æß╗Ö cao, c├│ mß║Ęt x├║c t├Īc, alkane bß╗ŗ oxi ho├Ī cß║»t mß║Īch carbon bß╗¤i oxygen tß║Īo th├Ānh hß╗Śn hß╗Żp carboxylic acid:
|
\(\text{RC}{{\text{H}}_{\text{2}}}-\text{C}{{\text{H}}_{\text{2}}}\text{R }\!\!'\!\!\text{ + }\frac{\text{5}}{\text{2}}{{\text{O}}_{\text{2}}}\xrightarrow{xt,{{t}^{0}}}\text{RCOOH + R }\!\!'\!\!\text{ COOH + }{{\text{H}}_{\text{2}}}\text{O}\) |
- C├Īc acid b├®o mß║Īch d├Āi d├╣ng ─æß╗ā sß║Żn xuß║źt x├Ā ph├▓ng v├Ā c├Īc chß║źt tß║®y rß╗Ła ─æŲ░ß╗Żc ─æiß╗üu chß║┐ bß║▒ng phŲ░ŲĪng ph├Īp oxi ho├Ī cß║»t mß║Īch c├Īc alkane C25 ŌĆō C35.
1.4. Nguß╗ōn alkane trong tß╗▒ nhi├¬n, ß╗®ng dß╗źng cß╗¦a alkane
a. Nguß╗ōn alkane trong tß╗▒ nhi├¬n - ─Éiß╗üu chß║┐ alkane trong c├┤ng nghiß╗ćp.
- Alkane d├╣ng trong c├┤ng nghiß╗ćp ─æŲ░ß╗Żc lß║źy tß╗½ alkane c├│ trong tß╗▒ nhi├¬n.
PhŲ░ŲĪng ph├Īp ─æiß╗üu chß║┐ alkane ß╗¤ thß╗ā kh├Ł trong c├┤ng nghiß╗ćp
- C├Īc alkane ß╗¤ thß╗ā kh├Ł chß╗¦ yß║┐u ─æŲ░ß╗Żc lß║źy tß╗½ khi thi├¬n nhi├¬n v├Ā kh├Ł dß║¦u mß╗Å.
- Sau khi loß║Īi bß╗Å c├Īc hß╗Żp chß║źt kh├┤ng phß║Żi l├Ā hydrocarbon (─æß║Ęc biß╗ćt l├Ā H2S v├Ā CO2), kh├Ł ─æŲ░ß╗Żc dß║½n qua ─æŲ░ß╗Øng ß╗æng dß║½n ─æß║┐n nŲĪi ti├¬u thß╗ź hoß║Ęc ─æŲ░ß╗Żc n├®n lß║Īi ß╗¤ dß║Īng lß╗Ång (ho├Ī lß╗Ång ß╗¤ ├Īp suß║źt cao) ─æß╗ā dß╗ģ d├Āng vß║Łn chuyß╗ān.
- Kh├Ł dß║¦u mß╗Å ho├Ī lß╗Ång l├Ā LPG, c├▓n kh├Ł thi├¬n nhi├¬n ho├Ī lß╗Ång l├Ā LNG (liquefied natural gas).
PhŲ░ŲĪng ph├Īp ─æiß╗üu chß║┐ alkane ß╗¤ thß╗ā lß╗Ång, rß║»n trong c├┤ng nghiß╗ćp
- Khi chŲ░ng cß║źt dß║¦u mß╗Å nhß║Łn ─æŲ░ß╗Żc hß╗Śn hß╗Żp alkane c├│ chiß╗üu d├Āi mß║Īch carbon kh├Īc nhau ß╗¤ c├Īc ph├ón ─æoß║Īn s├┤i kh├Īc nhau.
- ─Éß╗ā nhß║Łn ─æŲ░ß╗Żc c├Īc alkane tinh khiß║┐t cß║¦n phß║Żi c├│ c├Īc c├┤ng nghß╗ć t├Īch v├Ā tinh chß║┐ rß║źt phß╗®c tß║Īp.
b. ß╗©ng dß╗źng
- Nhi├¬n liß╗ću x─āng, diesel, phß║Żn lß╗▒c,ŌĆ”
- Nguy├¬n liß╗ću sß║Żn xuß║źt ph├ón b├│n urea, kh├Ł hydrogen v├Ā ammonia, benzene, toluene, ─æß╗ōng ph├ón xylene.
- C├Īc alkane tß╗½ C11 ─æß║┐n C20 (vaseline) ─æŲ░ß╗Żc d├╣ng l├Ām kem dŲ░ß╗Īng da, s├Īp nß║╗, thuß╗æc mß╗Ī. C├Īc alkane tß╗½ C20 ─æß║┐n C35 (paraffin) ─æŲ░ß╗Żc d├╣ng l├Ām nß║┐n, s├Īp,...
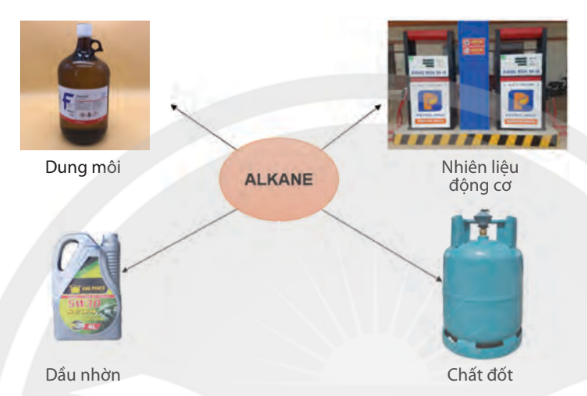
H├¼nh 12.1. Mß╗Öt sß╗æ ß╗®ng dß╗źng cß╗¦a alkane trong ─æß╗Øi sß╗æng
c. Nhi├¬n liß╗ću v├Ā m├┤i trŲ░ß╗Øng
ŌĆō Kh├Ł thß║Żi do c├Īc phŲ░ŲĪng tiß╗ćn giao th├┤ng hoß║Īt ─æß╗Öng thß║Żi ra trong qu├Ī tr├¼nh ─æß╗æt ch├Īy nhi├¬n liß╗ću l├Ā hß╗Śn hß╗Żp cß╗¦a c├Īc kh├Ł v├Ā c├Īc hß║Īt kh├Īc nhau.
ŌĆō Kh├│i thß║Żi v├Ā c├Īc hß║Īt bß╗źi mß╗ŗn thß║Żi v├Āo kh├Ł quyß╗ān l├Ā t├Īc nh├ón g├óy ß║Żnh hŲ░ß╗¤ng nghi├¬m trß╗Źng ─æß║┐n sß╗®c khoß║╗ ngŲ░ß╗Øi d├ón.

H├¼nh 12.2. Nguß╗ōn ├┤ nhiß╗ģm do c├Īc phŲ░ŲĪng tiß╗ćn giao th├┤ng
B├Āi tß║Łp minh hß╗Źa
B├Āi 1. H├Ży gß╗Źi t├¬n thay thß║┐ cß╗¦a hß╗Żp chß║źt (CH3)2CHCH2CH2CH3?
HŲ░ß╗øng dß║½n giß║Żi
\(\begin{array}{*{35}{l}} \overset{1}{\mathop{C}}\,{{H}_{3}}-\underset{\,\left| {} \right.}{\overset{2}{\mathop{C}}}\,H-\overset{3}{\mathop{C}}\,{{H}_{2}}-\overset{4}{\mathop{C}}\,{{H}_{2}}-\overset{5}{\mathop{C}}\,{{H}_{3}} \\ \text{ }\!\!~\!\!\text{ }\!\!~\!\!\text{ }\!\!~\!\!\text{ }\!\!~\!\!\text{ }\!\!~\!\!\text{ }\!\!~\!\!\text{ }\!\!~\!\!\text{ }\!\!~\!\!\text{ }\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,C{{H}_{3}} \\ \end{array}\)
- ─É├Īnh sß╗æ v├Āo mß║Īch carbon d├Āi nhß║źt, bß║»t ─æß║¦u tß╗½ ph├Ła gß║¦n nh├Īnh hŲĪn ŌćÆ 2-methylpentane.
B├Āi 2. ─Éß╗æt ch├Īy ho├Ān to├Ān 1 hydrocarbon A (l├Ā chß║źt kh├Ł, ─ækc) rß╗ōi dß║½n sß║Żn phß║®m lß║¦n lŲ░ß╗Żt qua b├¼nh 1 ─æß╗▒ng H2SO4 ─æß║Ęc v├Ā b├¼nh 2 chß╗®a NaOH dŲ░ ngŲ░ß╗Øi ta thß║źy khß╗æi lŲ░ß╗Żng b├¼nh 1 t─āng 1,8g v├Ā khß╗æi lŲ░ß╗Żng b├¼nh 2 t─āng 3,52 gam. X├Īc ─æß╗ŗnh CTPT cß╗¦a A?
HŲ░ß╗øng dß║½n giß║Żi
- Khß╗æi lŲ░ß╗Żng b├¼nh 1 t─āng l├Ā khß╗æi lŲ░ß╗Żng cß╗¦a H2O ŌćÆ nH2O = 1,8/18= 0,1 mol
- Khß╗æi lŲ░ß╗Żng b├¼nh 2 t─āng l├Ā khß╗æi lŲ░ß╗Żng cß╗¦a CO2 ŌćÆ nCO2 = 3,52/44 = 0,08 mol
- Nhß║Łn thß║źy: nCO2 < nH2O ŌćÆ hydrocarbon l├Ā alkane
- Sß╗æ mol alkane l├Ā = 0,1 ŌĆō 0,08 = 0,02 mol
ŌćÆ n = nCO2:nalkane ŌĆŗ= 0,08 : 0,02 = 4
ŌćÆ CTPT cß╗¦a A l├Ā C4H10.
Luyß╗ćn tß║Łp B├Āi 12 H├│a 11 C├Īnh Diß╗üu
Hß╗Źc xong b├Āi hß╗Źc n├Āy, em c├│ thß╗ā:
ŌĆō N├¬u ─æŲ░ß╗Żc kh├Īi niß╗ćm, c├┤ng thß╗®c chung v├Ā nguß╗ōn alkane trong tß╗▒ nhi├¬n.
ŌĆō Tr├¼nh b├Āy ─æŲ░ß╗Żc quy tß║»c gß╗Źi t├¬n theo danh ph├Īp thay thß║┐; ├Īp dß╗źng gß╗Źi ─æŲ░ß╗Żc t├¬n cho mß╗Öt sß╗æ alkane (C1 - C10) mß║Īch kh├┤ng ph├ón nh├Īnh v├Ā mß╗Öt sß╗æ alkane mß║Īch nh├Īnh chß╗®a kh├┤ng qu├Ī 5 nguy├¬n tß╗Ł C
ŌĆō Giß║Żi th├Łch ─æŲ░ß╗Żc ─æß║Ęc ─æiß╗ām vß╗ü t├Łnh chß║źt vß║Łt l├Ł v├Ā t├Łnh chß║źt ho├Ī hß╗Źc cß╗¦a alkane.
ŌĆō Tr├¼nh b├Āy ─æŲ░ß╗Żc c├Īc ß╗®ng dß╗źng trong thß╗▒c tiß╗ģn v├Ā ß╗®ng dß╗źng cß╗¦a alkane.
3.1. Trß║»c nghiß╗ćm B├Āi 12 H├│a 11 C├Īnh Diß╗üu
C├Īc em c├│ thß╗ā hß╗ć thß╗æng lß║Īi nß╗Öi dung kiß║┐n thß╗®c ─æ├Ż hß╗Źc ─æŲ░ß╗Żc th├┤ng qua b├Āi kiß╗ām tra Trß║»c nghiß╗ćm H├│a hß╗Źc 11 CD B├Āi 12 cß╗▒c hay c├│ ─æ├Īp ├Īn v├Ā lß╗Øi giß║Żi chi tiß║┐t.
-
- A. Cß╗Öng vß╗øi halogen
- B. Thß║┐ vß╗øi halogen
- C. Cracking
- D. Dehydrogen ho├Ī
-
- A. 2
- B. 3
- C. 5
- D. 4
-
- A. 1 L oxygen phß║Żn ß╗®ng vß╗½a ─æß╗¦ vß╗øi 5 L propane.
- B. 1 L kh├Ł carbonic tß║Īo ra tß╗½ 3 L propane.
- C. 1 L nŲ░ß╗øc tß║Īo ra tß╗½ 0,8 L oxygen.
- D. 1 L oxygen tham gia phß║Żn ß╗®ng tß║Īo 0,6 L kh├Ł carbonic.
C├óu 4-10: Mß╗Øi c├Īc em ─æ─āng nhß║Łp xem tiß║┐p nß╗Öi dung v├Ā thi thß╗Ł Online ─æß╗ā cß╗¦ng cß╗æ kiß║┐n thß╗®c vß╗ü b├Āi hß╗Źc n├Āy nh├®!
3.2. B├Āi tß║Łp SGK B├Āi 12 H├│a 11 C├Īnh Diß╗üu
C├Īc em c├│ thß╗ā xem th├¬m phß║¦n hŲ░ß╗øng dß║½n Giß║Żi b├Āi tß║Łp H├│a hß╗Źc 11 CD B├Āi 12 ─æß╗ā gi├║p c├Īc em nß║»m vß╗»ng b├Āi hß╗Źc v├Ā c├Īc phŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp.
Mß╗¤ ─æß║¦u trang 72 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Giß║Żi C├óu hß╗Åi 1 trang 73 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Giß║Żi C├óu hß╗Åi 2 trang 74 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Th├Ł nghiß╗ćm 1 trang 76 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Th├Ł nghiß╗ćm 2 trang 76 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Luyß╗ćn tß║Łp trang 77 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Th├Ł nghiß╗ćm 3 trang 78 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Giß║Żi C├óu hß╗Åi 3 trang 78 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Giß║Żi C├óu hß╗Åi 4 trang 79 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Vß║Łn dß╗źng trang 79 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Giß║Żi B├Āi 1 trang 80 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Giß║Żi B├Āi 2 trang 80 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Giß║Żi B├Āi 3 trang 80 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Giß║Żi B├Āi 4 trang 80 SGK H├│a hß╗Źc 11 C├Īnh diß╗üu ŌĆō CD
Hß╗Åi ─æ├Īp B├Āi 12 H├│a 11 C├Īnh Diß╗üu
Trong qu├Ī tr├¼nh hß╗Źc tß║Łp nß║┐u c├│ thß║»c mß║»c hay cß║¦n trß╗Ż gi├║p g├¼ th├¼ c├Īc em h├Ży comment ß╗¤ mß╗źc Hß╗Åi ─æ├Īp, Cß╗Öng ─æß╗ōng H├│a hß╗Źc HOC247 sß║Į hß╗Ś trß╗Ż cho c├Īc em mß╗Öt c├Īch nhanh ch├│ng!
Ch├║c c├Īc em hß╗Źc tß║Łp tß╗æt v├Ā lu├┤n ─æß║Īt th├Ānh t├Łch cao trong hß╗Źc tß║Łp!


%20v%C3%A0%20ethane%20(b).JPG)