Giải bài 17.22 trang 61 SBT Hóa học 10 Cánh Diều
Hình sau đây là một phần phổ khối lượng của chlorine. Phổ này có hai tín hiệu, là hai đường thẳng xuất phát từ tọa độ 35 và 37 trên trục hoành. Nhờ đó, người ta biết được nguyên tố chlorine có hai đồng vị bền là 35Cl và 37Cl.
Tỉ lệ số nguyên tử của hai đồng vị cũng là tỉ lệ độ cao h1 và h2 (hay tỉ lệ cường độ tương đối) của hai tín hiệu:
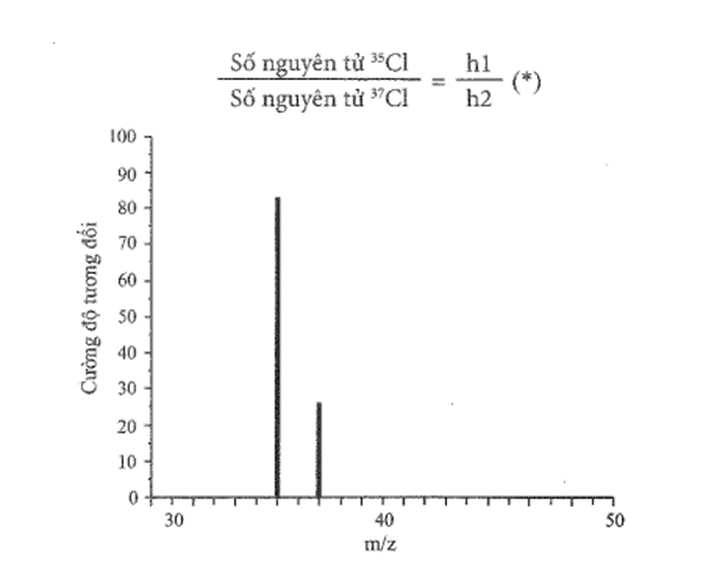
a) Dùng thước (độ chia nhỏ nhất là mm) để đo h1 và h2. Từ đó tính tỉ lệ h1 : h2.
b) Số nguyên tử đồng vị 35Cl gấp bao nhiêu lần số nguyên tử đồng vị 37Cl?
c) Xác định phần trăm số nguyên tử của mỗi đồng vị?
d) Xác định nguyên tử khối trung bình của chlorine.
Hướng dẫn giải chi tiết bài 17.22
Phương pháp giải:
- Công thức tính nguyên tử khối trung bình:
\(\bar M = \frac{{aA + bB}}{{100}}\)
+ a, b là số nguyên tử (hoặc % số nguyên tử) của mỗi đồng vị.
+ A, B là nguyên tử khối (hay số khối) của mỗi đồng vị.
- Xác định phần trăm các đồng vị
Gọi % của đồng vị 1 là x %
⇒ % của đồng vị 2 là (100 – x).
Lời giải chi tiết:
a) Dùng thước ta đo được:
h1 = 50 mm; h2 = 15 mm.
Vậy h1 : h2 = 50 : 15 = 10 : 3.
b) Số nguyên tử đồng vị 35Cl gấp 10/3 lần số nguyên tử đồng vị 37Cl.
c) Phần trăm số nguyên tử của mỗi đồng vị là:
\(\% {m_{{}^{35}Cl}} = \frac{{\frac{{10}}{3}}}{{\frac{{10}}{3} + 1}}.100\% = 76,9\% \) và \(\% {m_{{}^{37}Cl}} = 100\% - 76,9\% = 23,1\% \)
d) Nguyên tử khối trung bình của chlorine là:
\(\overline A = \frac{{35.76,9 + 37.23,1}}{{100}} = 35,46\)
-- Mod Hóa Học 10 HỌC247
Chưa có câu hỏi nào. Em hãy trở thành người đầu tiên đặt câu hỏi.





