Hướng dẫn Giải bài tập Hóa học 11 KNTT Bài 5 Ammonia - Muối ammonium môn Hoá học lớp 11 giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức.
-
Mở đầu trang 33 SGK Hóa học 11 Kết nối tri thức – KNTT
Từ ammonia, thông qua phản ứng nào có thể sản xuất phân đạm chứa ion ammonium? Ammonia đóng vai trò gì trong phản ứng đó?
-
Hoạt động 1 trang 33 SGK Hoá học 11 Kết nối tri thức – KNTT
Viết cấu hình electron của các nguyên tử H (Z = 1) và N (Z = 7).
-
Hoạt động 2 trang 33 SGK Hoá học 11 Kết nối tri thức – KNTT
Trình bày các bước lập công thức Lewis của phân tử ammonia.
-
Giải Câu hỏi 1 trang 34 SGK Hóa học 11 Kết nối tri thức – KNTT
Từ đặc điểm cấu tạo của phân tử ammonia, hãy giải thích tại sao các phân tử ammonia có khả năng tạo liên kết hydrogen mạnh với nhau.
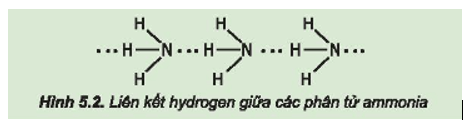
-
Giải Câu hỏi 2 trang 34 SGK Hóa học 11 Kết nối tri thức – KNTT
Hãy giải thích tại sao ammonia tan tốt trong nước?
-
Hoạt động trang 34 SGK Hoá học 11 Kết nối tri thức – KNTT
Trong công nghiệp, phản ứng giữa ammonia với acid được dùng để sản xuất phân bón:
NH3 + HCl → NH4Cl
NH3 + HNO3 → NH4NO3
2NH3 + H2SO4 → (NH4)2SO4
Xác định chất cho, chất nhận proton trong mỗi phản ứng trên. Dùng mũi tên để biểu diễn sự cho, nhận đó.
-
Giải Câu hỏi 3 trang 35 SGK Hóa học 11 Kết nối tri thức – KNTT
Trong hai phản ứng oxi hóa ammonia bằng oxygen ở trên, hãy:
a) Xác định các nguyên tử có sự thay đổi số oxi hóa.
b) Viết quá trình oxi hóa, quá trình khử.
-
Hoạt động trang 35 SGK Hoá học 11 Kết nối tri thức – KNTT
Sưu tầm một số hình ảnh để báo cáo, thuyết trình về ứng dụng của ammonia trong thực tiễn. Sử dụng các tính chất vật lí và hoá học để giải thích cơ sở khoa học của các ứng dụng này.
-
Hoạt động 1, 2, 3 trang 35 SGK Hoá học 11 Kết nối tri thức – KNTT
Vận dụng kiến thức về cân bằng hoá học, tốc độ phản ứng, biến thiên enthalpy để giải thích các điều kiện của phản ứng sản xuất ammonia, cụ thể:
1. Nếu tăng hoặc giảm nhiệt độ sẽ ảnh hưởng đến sự chuyển dịch cân bằng và tốc độ phản ứng như thế nào?
2. Nếu giảm áp suất, cân bằng chuyển dịch theo chiều nào? Tại sao không thực hiện ở áp suất cao hơn?
3. Vai trò của chất xúc tác trong phản ứng là gì?
-
Thí nghiệm trang 36 SGK Hóa học 11 Kết nối tri thức – KNTT
Nhận biết ion ammonium trong phân đạm
Chuẩn bị: phân bón potassium nitrate và phân bón ammonium chloride dạng rắn, dung dịch NaOH 20%, giấy pH; bình xịt tia nước cất, 2 ống nghiệm, kẹp gỗ, đèn cồn.
Tiến hành:
– Cho khoảng 1 g phân bón potassium nitrate vào ống nghiệm (1) và khoảng 1 g phân bón ammonium chloride vào ống nghiệm (2).
– Thêm vào mỗi ống nghiệm khoảng 3 mL nước cất, lắc đều cho tan hết.
– Nhỏ 1 mL dung dịch NaOH 20% vào mỗi ống nghiệm, đun nóng nhẹ trên đèn cồn.
– Đưa hai mẩu giấy pH đã tẩm ướt vào miệng mỗi ống nghiệm.
Quan sát hiện tượng và trả lời câu hỏi:
Dựa vào dấu hiệu nào để nhận biết ion ammonium? Giải thích bằng phương trình hoá học.
-
Giải Câu hỏi 4 trang 37 SGK Hóa học 11 Kết nối tri thức – KNTT
a) So sánh phân tử ammonia và ion ammonium về dạng hình học, số liên kết cộng hoá trị, số oxi hoá của nguyên tử nitrogen.
b) Viết phương trình hoá học minh hoạ tính acid/base của ammonia và ammonium.






