Để giúp các em nắm vững phương pháp giải bài tập hóa học, HOC247 xin cung cấp tài liệu Phương pháp giải bài tập có chất dư trong phản ứng hóa học môn Hóa học 8 được sưu tầm và tổng hợp dưới đây. Hi vọng sẽ giúp các em củng cố kiến thức và ôn luyện thật tốt.
PHƯƠNG PHÁP GIẢI BÀI TẬP CÓ CHẤT DƯ TRONG PHẢN ỨNG HÓA HỌC
I. Lý thuyết & phương pháp giải
Bài toán cho biết lượng của hai chất tham gia và yêu cầu tính lượng chất tạo thành. Trong số hai chất tham gia phản ứng sẽ có một chất phản ứng hết, chất kia có thể phản ứng hết hoặc dư.
Các bước giải toán:
Bước 1: Tính số mol: đổi lượng chất đề bài cho (khối lượng, thể tích) ra số mol.
Bước 2: Viết và cân bằng phương trình hóa học:
aA + bB → cC + dD
Bước 3: So sánh tỉ lệ: nA/a và nB/b ( nA, nB lần lượt là số mol của A và B)
+ nA/a = nB/b => A và B là 2 chất phản ứng hết (vừa đủ)
+ nA/a > nB/b => Sau phản ứng thì A còn dư và B đã phản ứng hết
+ nA/a < nB/b => Sau phản ứng thì A phản ứng hết và B còn dư
Tính lượng các chất theo chất phản ứng hết.
Lưu ý: Bài toán cho cả lượng chất tham gia và lượng chất sản phẩm thì tính toán theo lượng chất sản phẩm.
II. Ví dụ minh họa
Ví dụ 1: Cho 6,5 gam kẽm tác dụng với 36,5 gam dung dịch HCl thu được ZnCl2 và khí H2 . Tính khối lượng muối tạo thành sau phản ứng.
Hướng dẫn giải:
nZn = 6,5/65 = 0,1 mol
nHCl = 36,5/36,5 = 0,1 mol
Phương trình hóa học: Zn + 2HCl → ZnCl2 + H2↑
Xét tỉ lệ:
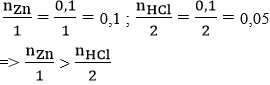
nên sau phản ứng HCl hết, Zn còn dư, lượng các chất tính theo lượng HCl
Zn + 2HCl → ZnCl2 + H2↑
0,1 → 0,05 (mol)
Khối lượng muối tạo thành sau phản ứng là:
mZnCl2 = nZnCl2 .MZnCl2 = 0,05 . (65 + 35,5.2) = 6,8 gam
Ví dụ 2: Khi cho miếng nhôm tan hết vào dung dịch có chứa 0,5 mol HCl thì thu được muối AlCl3 và 3,36 lít khí hiđro (đktc).
a. Tính khối lượng miếng nhôm đã phản ứng
b. Axit clohiđric còn dư hay không? Nếu còn dư thì khối lượng dư là bao nhiêu?
Hướng dẫn giải:
Chú ý: Bài toán cho cả lượng chất tham gia (0,5 mol HCl) và lượng chất sản phẩm (3,36 lít khí H2) thì tính toán lượng chất phản ứng theo lượng chất sản phẩm.
nH2 = 3,36/22,4 = 0,15 mol
a. Phương trình hóa học:
2Al + 6HCl → 2AlCl3 + 3H2↑
2 ← 3 mol
0,1 ← 0,15 (mol)
Khối lượng miếng nhôm đã phản ứng là:
mAl = nAl.MAl = 0,1.27 = 2,7 gam
b. Theo phương trình, nHCl phản ứng = 2nH2 = 0,15.2 = 0,3 mol
nHCl dư = nHCl ban đầu - nHCl phản ứng = 0,5 - 0,3 = 0,2 mol
Khối lượng HCl dư = 0,2 . 36,5 = 7,3 gam
Ví dụ 3: Sắt tác dụng với dung dịch CuSO4 thu được muối FeSO4 và Cu
Nếu cho 11,2 gam sắt vào dung dịch chứa 40 gam CuSO4 thì sau phản ứng thu được khối lượng Cu là bao nhiêu?
Hướng dẫn giải:
nFe = 11,2/56 = 0,2 mol
nCuSO4 = 40/(64 +32+16.4) = 0,25 mol
Phương trình hóa học: Fe + CuSO4 → FeSO4 + Cu
Xét tỉ lệ:
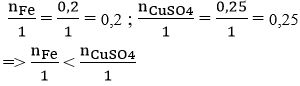
nên sau phản ứng Fe hết, CuSO4 còn dư, tính số mol Cu thu được theo số mol Fe.
Fe + CuSO4 → FeSO4 + Cu
1 → 1 mol
0,2 → 0,2 (mol)
Khối lượng Cu tạo thành sau phản ứng là:
mCu = nCu .MCu = 0,2 . 64 = 12,8 gam
III. Bài tập vận dụng
Câu 1: Cho 5,6 gam Fe phản ứng với 0,15 mol HCl theo phương trình:
Fe + 2HCl → FeCl2 + H2. Kết luận nào sau đây là chính xác:
A. Fe là chất hết.
B. HCl là chất hết.
C. Cả 2 chất cùng hết.
D. Cả 2 chất cùng dư.
Đáp án
Đáp án B
nFe = 5,6/56 = 0,1 mol
nHCl = 0,15 mol
Phương trình hóa học: Fe + 2HCl → FeCl2 + H2↑
Xét tỉ lệ:
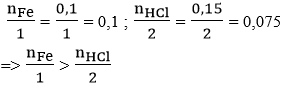
nên sau phản ứng HCl hết, Fe còn dư
Câu 2: Cho phương trình hóa học: CuO + 2HCl → CuCl2 + H2O
Nếu cho 4 gam CuO tác dụng với 2,92 gam HCl thì sau phản ứng kết luận nào sau đây đúng?
A. HCl là chất dư.
B. CuO là chất dư.
C. Cả 2 chất cùng hết.
D. Cả 2 chất cùng dư.
---Để xem tiếp nội dung của tài liệu các em vui lòng xem online hoặc tải về máy---
Trên đây là trích dẫn một phần nội dung tài liệu Phương pháp giải bài tập có chất dư trong phản ứng hóa học môn Hóa học 8. Để xem thêm nhiều tài liệu tham khảo hữu ích khác các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Ngoài ra các em học sinh có thể tham khảo các tài liệu cùng chuyên mục:
- Phương pháp giải bài tập tính theo phương trình hóa học môn Hóa học 8
- Dạng bài tập xác định công thức hóa học hợp chất khi biết thành phần môn Hóa học 8
Chúc các em học tốt!







