HỌC247 xin giới thiệu đến các em Bộ 6 đề thi HK1 môn Hóa học 11 năm 2018 - 2019. Tài liệu được biên soạn gồm câu hỏi trắc nghiệm và tự luận có đáp án đi kèm nhằm giúp các em tự luyện tập với các câu hỏi lý thuyết đa dạng, ôn tập lại các kiến thức cần nắm một cách hiệu quả, chuẩn bị thật tốt cho các kỳ thi sắp tới. Mời các em cùng tham khảo.
BỘ 6 ĐỀ THI HK1 MÔN HÓA HỌC 11 NĂM HỌC 2018 - 2019
Đề 1:
1. Dung dịch X có [H+] = 10-5 M. pH của dung dịch X là
A. 3 B. 2 C. 5 D. 4
2. Chất nào sau đây không phải là chất điện li
A. BaSO4 B. CH3COOH C. Ca(OH)2 D. C2H5OH
3. Dãy ion nào sau đây không cùng tồn tại trong một dung dịch
A. NH4+, Na+, CO32+, SO42-
B. K+, Zn2+, Cl-, Br-
C. Ag+, Al3+, PO43-, Cl-
D. Ba2+, Mg2+, NO3-, Cl-
4. Cho dung dịch X chứa 0,2 mol Na+; 0,15 mol Ca2+; 0,1 mol Cl- và ion NO3-. Số mol NO3- trong dung dịch là
A. 0,25 mol B. 0,15 mol C. 0,4 mol D. 0,3 mol
5. Trộn lẫn V (ml) dung dịch NaOH 0,01M với V (ml) dung dịch HCl 0,03M thu được 2V (ml) dung dịch Y. Dung dịch Y có pH là
A. 4 B. 3 C. 2 D. 5
6. Trong các dung dịch: HNO3, NaCl, Na2SO4, Ca(OH)2, KHSO4, Mg(NO3)2. Có bao nhiêu chất tác dụng được với dung dịch Ba(HCO3)2
A. 2 B. 3 C. 4 D. 5
7. Người ta điều chế một lượng nhỏ khí nito tinh khiết trong phòng thí nghiệm bằng cách nào sau đây
A. Chưng cất phân đoạn không khí lỏng B. Nhiệt phân dung dịch NH4NO2 bão hòa
C. Dùng photpho để đốt cháy hết oxi không khí D. Cho không khí đi qua bột đồng nung nóng
8. Tính chất hóa học đặc trưng của NH3 là
A. tính khử và tính bazo
B. Tính bazo và tính oxi hóa
C. Tính khử
D. Tính oxi hóa
9. Trong công nghiệp, để sản xuất H3PO4 có độ tinh khiết và nồng độ cao, người ta làm cách nào sau đây
A. Cho dung dịch H2SO4 đặc, nóng tác dụng với quặng apatic
B. Đốt cháy photpho trong oxi dư, cho sản phẩm tác dụng với nước
C. Cho photpho tác dụng với dung dịch HNO3 đặc nóng
D. Cho dung dịch axit H2SO4 đặc, nóng tác dụng với quặng photphoric
10. Thành phần chính của phân đạm ure là
A. (NH2)2CO B. Ca(H2PO4)2 C. KCl D. K2SO4
---(Để xem nội dung đầy đủ, chi tiết đề số 1 vui lòng xem tại online hoặc đăng nhập để tả về máy)---
Đề 2
Câu 1: Liên kết hoá học chủ yếu trong hợp chất hữu cơ là:
A. Liên kết hiđrô. B. Liên kết cho nhận. C. Liên kết cộng hoá trị. D. Liên kết ion.
Câu 2: Tính khử của cacbon thể hiện ở phản ứng nào trong các phản ứng sau:
A. 2C + Ca → CaC2 B. C + CO2 → 2CO
C. C + 2H2 → CH4 D. 3C + 4Al → Al4C3
Câu 3: Thêm 0,15 mol KOH vào dung dịch chứa 0,1 mol H3PO4. Sau phản ứng, trong dung dịch có các muối:
A. KH2PO4 K2HPO4,K3PO4 B. K2HPO4, K3PO4
C. KH2PO4, K2HPO4 D. KH2PO4, K3PO4
Câu 4: Cho dung dịch Na2CO3 đến dư vào dung dịch có chứa 9,5 gam muối Clorua của kim loại nhóm IIA thì thu được 8,4 gam kết tủa. Công thức muối clorua của kim loại nhóm IIA đã dùng là:
A. BeCl2. B. MgCl2. C. CaCl2. D. BaCl2.
Câu 5: Phương trình phản ứng nào dưới đây có phương trình ion rút gọn là: H+ + OH- → H2O :
A. NaOH + HNO3 → NaNO3 + H2O B. Mg(OH)2 + 2HNO3→ Mg(NO3)2+ 2H2O
C. NH4Cl + NaOH→ NH3 + H2O + NaCl D. Cu(OH)2 + 2HCl → CuCl2 + 2H2O
Câu 6: Cho V lít khí CO2 (đktc) hấp thụ hoàn toàn vào dung dịch Ca(OH)2, thu được 150 gam kết tủa và dung dịch X. Đun kỹ dung dịch X thu thêm được 50 gam kết tủa. Giá trị V là:
A. 11,2. B. 56,0. C. 44,8. D. 3,36.
Câu 7: Cho 300 ml dd AlCl3 1M tác dụng với 500 ml dd NaOH 2M thì khối lượng kết tủa thu được là:
A. 7,8 gam. B. 15,6 gam. C. 23,4 gam. D. 25,2 gam.
Câu 8: Để khắc chữ lên thủy tinh người ta dựa vào phản ứng:
A. SiO2 + 2NaOH →Na2SiO3 + CO2 B. SiO2 + Na2CO3 →Na2SiO3 + CO2
C. SiO2 + Mg → 2MgO + Si D. SiO2 + 4HF →SiF4 + 2H2O
Câu 9: Dãy các ion nào có thể cùng tồn tại trong cùng một dung dịch:
A. Cl−, NO3−, Al3+, Zn2+ B. Ca2+, Cl−, Ag+, NO3−
C. Ba2+, SO32−, Mg2+, SO42− D. Al3+, Ca2+, CO32-, Cl-
Câu 10: Sản phẩm của phản ứng nhiệt phân muối Zn(NO3)2 là:
A. Zn(NO3)2, O2 B. ZnO, NO, O2 C. Zn, NO2 ,O2 D. ZnO, NO2, O2
---(Để xem nội dung đầy đủ, chi tiết đề số 2 vui lòng xem tại online hoặc đăng nhập để tả về máy)---
Đề 3
Câu 1: Để khắc hình, khắc chữ lên thủy tinh người ta dựa vào phản ứng nào sau đây?
A. SiO2 + 2NaOH → Na2SiO3 + H2O. B. SiO2 + 2Mg → 2MgO + Si
C. SiO2 + Na2CO3 → Na2SiO3 + CO2. D. SiO2 + 4HF → SiF4 + 2H2O.
Câu 2: Cacbon phản ứng được với nhóm chất nào sau đây
A. Fe2O3, MgO, CO2, HNO3, H2SO4
B. Fe2O3, Ca, CO2, H2, HNO3, H2SO4
C. CO2, H2O, HNO3, H2SO4, CaO
D. CO2, Al2O3, Ca, CaO, HNO3, H2SO4
Câu 3: Phát biểu nào sau đây đúng nhất?
A. Al(OH)3 là một bazơ lưỡng tính. B. Al(OH)3 là một bazơ.
C. Al(OH)3 là một hiđrôxit lưỡng tính. D. Al(OH)3 là một chất lưỡng tính.
Câu 4: Cho m gam Cu tác dụng hoàn toàn với dung dịch axit HNO3 loãng, dư thì thu được 4,48 lit khí NO (đktc) duy nhất. Giá trị của m là:
A. 19,2 gam B. 6,4 gam C. 25,6 gam D. 12,8 gam
Câu 5: Khử hoàn toàn 24g hỗn hợp CuO và Fe2O3 có tỉ lệ mol là 1:1 cần 8,96 lít CO(đktc). Phần trăm khối lượng của CuO và Fe2O3 trong hỗn hợp là:
A. 66,67% và 33,33% B. 33,33% và 66,67% C. 59,67% và 40,33% D. 40,33% và 59,67%
Câu 6: Những ion nàu sau đây cùng tồn tại trong một dung dịch?
A. \(M{g^{2 + }};\,SO_4^{2 - };\,C{l^ - };\,A{g^ + }.\)
B. \(B{a^{2 + }};\,F{e^{3 + }};\,O{H^ - };\,N{a^ + }.\)
C. \({H^ + };\,C{l^ - };\,N{a^ + };\,A{l^{3 + }}.\)
D. \(C{u^{2 + }};\,S_{}^{2 - };\,C{l^ - };\,F{e^{2 + }}.\)
Câu 7: Trong dung dịch H3PO4 có chứa những ion nào sau đây?
A. \({H^ + };\,{H_2}PO_4^ - ;\,HPO_4^{2 - };\,PO_4^{3 - }.\)
B. \({H^ + };\,PO_4^{3 - };\,{H_2}O;\,\,{H_3}P{O_4}.\)
C. \({H^ + };\,PO_4^{3 - }.\)
D. \({H^ + };\,{H_2}PO_4^ - ;\,HPO_4^{2 - };\,PO_4^{3 - };\,{H_3}PO_4^{}.\)
Câu 8: Cho 4,8 gam Mg tan hoàn toàn trong dung dịch HNO3 thấy thoát ra hỗn hợp 2 khí NO và NO2 có tỉ khối đối với hiđrô bằng 19. Thể tích hỗn hợp đó ở điều kiện tiêu chuẩn là:
A. 2,24 lit B. 4,48 lit C. 1,12 lit D. 0,448 lit
Câu 9: Cần thêm bao nhiêu lần thể tích nước (V2) so với thể tích ban đầu (V1) để pha loãng dung dịch HCl có pH=3 thành dung dịch có pH=4?
A. V1 = 9V2. B. V1 = 10V2. C. V2 = 10V1. D. V2 = 9V1.
Câu 10: Dung dịch X chứa các ion: . Chia ddịch X thành 2 phần bằng nhau:
Phần 1: Tác dụng với lượng dư dung dịch NaOH, đun nóng thu được 0,672 lit khí (ở đktc) và 1,07 gam kết tủa.
Phần 2: Tác dụng với lượng dư dung dịch BaCl2, thu được 4,66 gam kết tủa.
Tổng khối lượng các muối khan thu được khi cô cạn dung dịch X là (quá trình cô cạn chỉ có nước bay hơi)
A. 7,04 gam B. 7,46 gam C. 3,73 gam D. 3,52 gam
---(Để xem nội dung đầy đủ, chi tiết đề số 3 vui lòng xem tại online hoặc đăng nhập để tả về máy)---
Đề 5
I. TRẮC NGHIỆM
Câu 1: Trong dung dịch, cặp chất nào sau đây không xảy ra phản ứng?
A. SO42-, Ba2+ B. OH-, H+ C. H+, CO32- D. Na+, NO3-
Câu 2: Trong các dung dịch sau đây, dung dịch nào dẫn điện được?
A. saccarozơ B. glixerol C. axit sunfuric D. ancol etylic
Câu 3: Cho TN như hình vẽ. Hiện tượng xảy ra trong thí nghiệm là
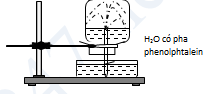
A. nước phun vào bình và chuyển thành màu hồng.
B. nước phun vào bình và chuyển thành màu tím.
C. nước phun vào bình và chuyển thành màu xanh.
D. nước phun vào bình và không có màu.
Câu 4: Một dung dịch có [H+] = 1,0. 10-10M. Môi trường của dung dịch là
A. kiềm. B. trung tính. C. axit. D. không thể xác định.
Câu 5: Phản ứng nhiệt phân không đúng là
A. 2KNO3 → 2KNO2 + O2 B. NH4NO3 → N2O + 2H2O
C. NH4Cl → NH3 + HCl D. Cu(NO3)2 → Cu + 2NO2 + O2
Câu 6: Có 3 dung dịch HCl, CH3COOH, H2SO4 có cùng nồng độ mol và có pH lần lượt là a,b,c. Kết luận nào sau đây đúng?
A. a < b < c. B. c < a < b. C. b < a < c. D. a = b = 2c.
Câu 7: Trong một dung dịch có chứa 0,01 mol Ca2+; x mol Al3+; 0,02 mol Cl- và 0,015 mol SO42-. Cô cạn dung dịch trên ta thu được y gam chất rắn. Giá trị của x và y lần lượt là:
A. 0,01 và 5,2 B. 0,01 và 2,82 C. 0,025 và 3,225 D. 0,025 và 6,415
Câu 8: Giải thích tại sao khả năng dẫn điện của nước vôi trong để trong không khí giảm dần theo thời gian?
A. Vì Ca(OH)2 phản ứng với CO2 trong không khí tạo kết tủa làm giảm nồng độ các ion.
B. Vì nước bay hơi làm nồng độ các ion trong dung dịch tăng.
C. Vì Ca(OH)2 bị phân hủy làm giảm nồng độ các ion trong dung dịch.
D. Vì có lẫn thêm các tạp chất bẩn từ không khí bay vào.
Câu 9: Trong công nghiệp N2 được sản xuất bằng phương pháp nào sau đây?
A. Nhiệt phân muối NH4NO2 B. Đốt cháy khí amoniac
C. Chưng cất phân đoạn không khí lỏng D. Phân hủy protein
Câu 10: Dung dịch HCl 0,01M có pH bằng A. 12 B. 7 C. 2 D. 4
---(Để xem nội dung đầy đủ, chi tiết đề số 5 vui lòng xem tại online hoặc đăng nhập để tả về máy)---
Đề 6
I. TRẮC NGHIỆM
Câu 1: Dãy chất nào sau đây, trong nước đều là chất điện li mạnh ?
A. H2SO4, Cu(NO3)2, CaCl2, NH3. B. HCl, H3PO4, Fe(NO3)3, NaOH.
C. HNO3, CH3COOH, BaCl2, KOH. D. H2SO4, MgCl2, Al2(SO4)3, Ba(OH)2.
Câu 2: Trong dung dịch H3PO4 (bỏ qua sự phân li của H2O) chứa bao nhiêu loại ion ?
A. 2. B. 3. C. 4. D. 5.
Câu 3: Dung dịch A chứa các ion: Fe2+ (0,1 mol), Al3+ (0,2 mol), Cl- (x mol), SO42- (y mol). Cô cạn dung dịch A thu được 46,9g muối rắn. Giá trị của x và y lần lượt là
A. 0,1 và 0,35. B. 0,3 và 0,2. C. 0,2 và 0,3. D. 0,4 và 0,2.
Câu 4: Dung dịch E chứa các ion Mg2+, SO42-, NH4+, Cl-. Chia dung dịch E ra 2 phần bằng nhau:
+ Phần I tác dụng với dung dịch NaOH dư, đun nóng, được 0,58 gam kết tủa và 0,672 lit khí (đktc).
+ Phần II tác dụng với dung dịch BaCl2 dư, được 4,66 gam kết tủa.
Tổng khối lượng các chất tan trong dung dịch E bằng
A. 6,11g. B. 3,055g. C. 5,35g. D. 9,165g.
Câu 5. Các ion nào sau không thể cùng tồn tại trong một dung dịch?
A. Na+, Mg2+, NO3- , SO42-
B. Ba2+, Al3+, Cl–, HSO4- .
C. Cu2+, Fe3+, SO42- , Cl–
D. K+, NH4+ , SO42–, PO42-
Câu 6: Trong các cặp chất cho dưới đây, cặp chất nào có thể cùng tồn tại trong một dung dịch?
A. AlCl3 và CuSO4. B. NH3 và AgNO3 . C. Na2ZnO2 và HCl. D. NaHSO4 và NaHCO3
Câu 7: Một hỗn hợp rắn X có a mol NaOH; b mol Na2CO3; c mol NaHCO3. Hoà tan X vào nước sau đó cho tác dụng với dung dịch BaCl2 dư ở nhiệt độ thường. Loại bỏ kết tủa, đun nóng phần nước lọc thấy có kết tủa nữa. Vậy có kết luận là
A. a = b = c. B. a > c. C. b > c. D. a < c.
Câu 8. Phương trình ion thu gọn: Ca2+ + CO32- → CaCO3 là của phản ứng xảy ra giữa cặp chất nào sau đây
1. CaCl2 + Na2CO3 2.Ca(OH)2 + CO2
3.Ca(HCO3)2 + NaOH 4. Ca(NO3)2 + (NH4)2CO3
A. 1 và 2. B. 2 và 3. C. 1 và 4. D. 2 và 4.
Câu 9: Hỗn hợp A gồm Na2O, NH4Cl, NaHCO3, BaCl2 (có cùng số mol). Cho hỗn hợp A vào nước dư, đun nóng sau các phản ứng xảy ra hoàn toàn thu được dung dịch chứa:
A. NaCl, NaOH. B. NaCl, NaOH, BaCl2 . C. NaCl. D. NaCl, NaHCO3, BaCl2.
Câu 10: Dãy các chất đều tác dụng với dung dịch Ca(OH)2 là:
A. Ba(NO3)2, Mg(NO3)2, HCl, CO2, Na2CO3
B. Mg(NO3)2, HCl, BaCO3, NaHCO3, Na2CO3 .
C. NaHCO3, Na2CO3, CO2, Mg(NO3)2, Ba(NO3)2
D. NaHCO3, Na2CO3, CO2, Mg(NO3)2, HCl.
---(Để xem nội dung đầy đủ, chi tiết đề số 6 vui lòng xem tại online hoặc đăng nhập để tả về máy)---
Trên đây là phần trích dẫn Bộ 6 đề thi HK1 môn Hóa học 11 năm 2018 - 2019, để xem toàn bộ nội dung chi tiết, mời các bạn cùng quý thầy cô vui lòng đăng nhập để tải về máy.
Ngoài ra các em có thể thử sức với hình thức trắc nghiệm online tại đây:
Chúc các em đạt điểm số thật cao trong kì thi sắp đến!







