Mời các em cùng tham khảo bộ tài liệu Bộ 3 đề thi HSG lần 2 môn Hóa học 11 năm 2019-2020 Trường THPT Lam Kinh. Với bộ tài liệu này sẽ giúp các em tự luyện tập, ôn tập lại các kiến thức cần nắm một cách hiệu quả, chuẩn bị thật tốt cho các kỳ thi sắp tới.
|
SỞ GD&ĐT THANH HÓA TRƯỜNG THPT LAM KINH |
ĐỀ KIỂM TRA CHẤT LƯỢNG LIÊN TRƯỜNG LẦN 2 MÔN HÓA HỌC 11 NĂM HỌC 2019-2020 |
ĐỀ SỐ 1:
Câu 1: (2 điểm)
1. Cho 2 nguyên tố X, Y, biết X có 3 lớp electron, có 3 electron độc thân còn Y có 3 lớp electron, có 7 electron hóa trị. Viết cấu hình electron, xác định vị trí của X, Y trong bảng hệ thống tuần hoàn?
2. Hợp chất X được tạo thành từ 7 nguyên tử của 3 nguyên tố. Tổng số proton của X bằng 18. Trong X có hai nguyên tố thuộc cùng một chu kì và thuộc hai nhóm A liên tiếp trong bảng tuần hoàn. Tổng số nguyên tử của nguyên tố có điện tích hạt nhân nhỏ nhất bằng 2,5 lần tổng số nguyên tử của hai nguyên tố còn lại. Xác định công thức cấu tạo của X.
Câu 2. (2,0 điểm)
1. Viết các phương trình phản ứng điều chế trực tiếp các chất: N2, HNO3, H3PO4 trong phòng thí nghiệm và phân ure trong công nghiệp.
2. Hoàn thành các phương trình phản ứng sau:
K2SO3 + KMnO4 + KHSO4 →
KMnO4 + FeCl2 + H2SO4 → Dung dịch chỉ chứa muối sunfat
Câu 3. (2,0 điểm)
1.Sục khí Cl2 vào dung dịch NaOH loãng thu được dung dịch A, hòa tan I2 vào dung dịch NaOH loãng thu được dung dịch B (các thí nghiệm được tiến hành ở nhiệt độ phòng).
a. Viết phương trình hóa học của các phản ứng xảy ra và cho nhận xét.
b. Nêu hiện tượng và viết phương trình hóa học các phản ứng xảy ra khi cho lần lượt các dung dịch hỗn hợp HCl và FeCl2, dung dịch Br2, dung dịch H2O2 vào dung dịch A (không có Cl2 dư).
2. Cho cân bằng hóa học sau trong bình kín: xA(k) + yB(k) ⇔ zC(k). Biết rằng (x + y) >z và khi giảm nhiệt độ của hệ cân bằng lên thấy áp suất trong bình tăng. Hãy cho biết (có giải thích):
a. Phản ứng thuận là tỏa nhiệt hay thu nhiệt?
b. Khi giảm nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 là tăng hay giảm?
Câu 4 ( 2,0 điểm)
Một hỗn hợp rắn A gồm kim loại M và một oxit của kim loại đó. Người ta lấy ra ba phần, mỗi phần có 59,08 gam A.
- Phần 1: Hoà tan vào dung dịch HCl thu được 4,48 lít khí hiđro.
- Phần 2: Hoà tan vào dung dịch hỗn hợp gồm NaNO3 và H2SO4 thu được 4,48 lít khí NO.
- Phần 3: Đem nung nóng rồi cho tác dụng với khí hiđro dư cho đến khi được một chất rắn duy nhất, hoà tan hết chất rắn đó bằng nước cường toan thì có 17,92 lít khí NO thoát ra.
Biết các thể tích khí đều đo ở điều kiện tiêu chuẩn. Hãy tính nguyên tử khối, cho biết tên của kim loại M và công thức oxit trong hỗn hợp A.
Câu 5. (2,0 điểm)
Cho 6,048 gam Mg phản ứng hết với 189 gam dung dịch HNO3 40% thu được dung dịch X (không chứa muối amoni) và hỗn hợp khí là oxit của nitơ. Thêm 392 gam dung dịch KOH 20% vào dung dịch X, rồi cô cạn và nung sản phẩm đến khối lượng không đổi thì thu được 118,06 gam hỗn hợp chất rắn. Hãy xác định nồng độ % của các chất trong X.
Câu 6. (2,,0 điểm)
1. Đốt cháy hoàn toàn hiđrocacbon R, thu được tỉ lệ số mol H2O và CO2 tương ứng bằng 1,125.
a) Xác định công thức phân tử của R.
b) R1 là đồng phân của R, khi tác dụng với Cl2, điều kiện thích hợp, tỉ lệ mol 1:1 thì thu được một dẫn xuất mono clo duy nhất (R2). Gọi tên R1, R2 và viết phương trình phản ứng xảy ra.
2. Hoàn thành các phương trình phản ứng:
a. Glixerol +Cu(OH)2 →
b. Naphtalen + O2 →
c. Nitrobenzen + Cl2 →
Câu 7. ( 2 điểm)
Thực hiện phản ứng cracking m gam isobutan, thu được hỗn hợp A gồm các hiđrocacbon. Dẫn hỗn hợp A qua bình nước brom có hòa tan 6,4 gam Brom. Nước brom mất màu hết, có 4,704 lít hỗn hợp khí B (đktc) gồm các hiđrocacbon thoát ra. Tỉ khối hơi B so với hiđro bằng 117/7 Trị số của m là bao nhiêu?
Câu 8. (2,0 điểm)
Cho m gam hỗn hợp X gồm metanol, etilen glycol và glixerol tác dụng với Na dư thu được một lượng hiđro bằng lượng hiđro thoát ra từ phản ứng điện phân 538,8 ml dung dịch NaCl 2M điện cực trơ có màng ngăn xốp đến khi dung dịch chứa 2 chất tan có khối lượng bằng nhau. Đốt m gam hỗn hợp X cần 17,696 lít O2 (đktc).Tính giá trị m .
Câu 9. ( 2 điểm)
1. Hòa tan một số muối cacbonat trung hòa vào nước thu được dd A và chất rắn B. Lấy một ít dd A đem đốt nóng trên đũa Platin ở nhiệt độ cao thấy ngọn lửa có màu vàng. Cho dd NaOH td với một tí dd A đun nóng nhẹ thấy thoát ra khí có mùi khai, làm xanh quỳ tím ẩm. Hòa tan chất B bằng dd H2SO4 loãng, dư thu được dd C, kết tủa D và khí E. Cho D td với dd NaOH đặc thấy kết tủa tan một phần. Cho dd C td với dd NaOH dư được dd F và kết tủa G hóa nâu trong không khí. Cho từ từ dung dịch HCl vào dung dịch F thấy xuất hiện kết tủa trắng tan trong HCl dư. Xác định các muối cacbonat có trong hỗn hợp ban đầu, viết phương trình phản ứng( chỉ xét các muối thường gặp đối với học sinh phổ thông).
2. Bằng phương pháp hóa học tách các chất sau trong hỗn hợp bột gồm: đá vôi, vôi sống, thạch cao, muối ăn.
Câu 10. (2 điểm)
1. Cho mô hình điều chế khí Clo trong phòng thí nghiệm.
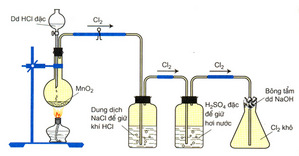
a. Hãy viết phương trình phản ứng điều chế clo
b. Có thể đổi vị trí của bình NaCl và bình H2SO4 được không? Tại sao?
2. Vì sao ném đất đèn xuống ao làm cá chết?
ĐỀ SỐ 2:
Câu 1: (2đ)
1. X ở chu kì 3, Y ở chu kì 2. Tổng số electron lớp ngoài cùng của X và Y là 12. Ở trạng thái cơ bản số electron trên các phân lớp p của X nhiều hơn của Y là 8. Vậy X và Y thuộc nhóm nào?
2. Các nguyên tử và ion Na( Z=11), Na+, Mg(Z=12), Mg2+, Al(Z=13), Al3+, F-(Z=9), O2-(Z=8). Hãy sắp xếp các nguyên tử và ion trên theo chiều bán kính giảm dần, giải thích?
Câu 2:(2đ)
1. Ion X3+ có tổng số hạt là 79, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 19 hạt. Viết cấu hình electron của X, X2+.
2. Cân bằng các phương trình phản ứng sau theo phương pháp thăng bằng electron:
a) FeS2 + H2SO4 đặc → Fe2(SO4)3 + SO2 + H2O.
b) xFeCO3 + yFeS2 + HNO3 → Fe2(SO4)3 + CO2 + NO + H2O.
( biết x:y =1:3).
Câu 3: (2đ)
1. Viết phương trình phân tử và ion thu gọn của các phản ứng sau xảy ra trong dung dịch :
a). KNO3 + S + C →
b) Fe2O3 + HI →
c) NH4HCO3 + NaOHdư →
d) Ba(OH)2 dư + NaHCO3 →
2.Viết các phương trình phản ứng dạng ion thu gọn trong mỗi trường hợp sau:
Cho Ba vào dung dịch NaHCO3.
Cho từ từ CO2 đến dư qua dung dịch clorua vôi.
Cho NaAlO2 vào dung dịch NH4NO3.
Cho Ba(HSO3)2 vào dung dịch KHSO4.
Câu 4:(2đ)
1. Viết các phương trình phản ứng điều chế trực tiếp các chất: Si, N2, HNO3, H3PO4 trong phòng thí nghiệm và phân ure trong công nghiệp.
2. Đốt cháy hoàn toàn một hiđrocacbon X. Sản phẩm cháy thu được cho hấp thụ hết vào 200ml dung dịch Ca(OH)2 1M thấy có 10 gam kết tủa xuất hiện và khối lượng bình đựng dung dịch Ca(OH)2 tăng 20,4 gam. Lọc bỏ kết tủa cho nước lọc tác dụng với dung dịch Ba(OH)2 dư lại thu được kết tủa.Xác định công thức phân tử của X.
Câu 5:(2đ)
1. Viết các phương trình hóa học theo sơ đồ sau (ghi rõ điều kiện phản ứng, nếu có)
\(C{a_3}{P_2} \leftarrow P \to {P_2}{O_5} \to {H_3}P{O_4} \to N{a_2}HP{O_4} \to N{a_3}P{O_4} \to A{g_3}P{O_4}\)
2. Cho 200ml dung dịch NaOH 0,6M vào 100 ml dung dịch gồm HCl 0,2M và H2SO4 xM ; sau phản ứng thu được dung dịch có pH bằng 12. Tính x
Câu 6:(2đ)
1. Cho các sơ đồ phản ứng:
a) (A) + H2O → (B) + (X).
b) (A) + NaOH + H2O → (G) + (X).
c) (C) + NaOH → (X) + (E).
d) (E) + (D) + H2O → (B) + (H) + (I).
e) (A) + HCl → (D) + (X).
g) (G) + (D) + H2O → (B) + (H).
Biết A là hợp chất được tạo nên từ hai nguyên tố là nhôm và cacbon. Xác định các chất X, A, B, C, D, E, G, H, I và viết các phương trình phản ứng xảy ra.
2. Nhỏ từ từ dung dịch HCl vào 100 ml dung dịch A chứa hỗn hợp các chất tan NaOH 0,8M và Na2CO3 0,6M. Thấy lượng khí CO2 thoát ra theo đồ thị sau:
.png)
Tính x và y?
Câu 7:(2đ)
Nung 16,16gam một muối A được các sản phẩm khí và 3,2 gam một hợp chất rắn không tan trong nước. Nếu cho sản phẩm khí đi qua 200 gam dd NaOH 2,4%ở điều kiện xác định thì phản ứng vừa đủ và được dung dịch chứa 1 muối có nồng độ 4,79%. Xác định công thức muối A biết khi nung số oxi hóa của kim loại không đổi.
Câu 8: (2đ)
Hòa tan hoàn toàn hỗn hợp gồm FeS và FeCO3 bằng dung dịch HNO3 đặc nóng thu được hỗn hợp khí A gồm 2 khí X, Y có tỉ khối so với hiđro bằng 22,909.
a. Tính phần trăm khối lượng của mỗi muối trong hỗn hợp ban đầu.
b. Làm lạnh hỗn hợp khí A xuống nhiệt độ thấp hơn thu được hỗn hợp khí B gồm 3 khí X, Y, Z có tỉ khối so với hiđro là 31,5. Tính phần trăm khí X bị chuyển hóa thành Z.
Câu 9:(2đ)
Hòa tan hết 18,16 gam hỗn hợp gồm Fe, FeO, Fe3O4, Fe(OH)2, FeCO3 trong dung dịch chứa 0,15 mol KNO3 và 0,97 mol KHSO4 thu được dung dịch Y (trong dung dịch không có muối Fe2+) và 5,04 lít hỗn hợp khí X (đktc) chứa H2, NO và 0,03 mol khí CO2 nặng 5,91 gam. Nhúng thanh Fe vào dung dịch Y thấy khối lượng thanh Fe giảm m gam và thoát ra 0,448 lít khí H2 (đktc). Biết các phản ứng xảy ra hoàn toàn. Tính phần trăm khối lượng của Fe(OH)2 trong hỗn đầu.
Câu 10: (2đ)
Trong phòng thí nghiệm điều chế CO2 từ CaCO3 Và dung dịch HCl ( dung dịch X1), do đó khí CO2 thu được còn bị lẫn một ít hơi nước và khí hiđroclorua.
.png)
Để thu được CO2 tinh khiết có 2 học sinh(HS) cho sản phẩm khí đi qua 2 bình sau:
- HS1: dd X2 là NaHCO3 , dd X3 là H2SO4 đặc.
- HS2: dd X2 là H2SO4 đặc , dd X3 là .NaHCO3.
Hãy cho biết học sinh nào đúng? Viết các phương trình phản ứng giải thích cách làm.
ĐỀ SỐ 3:
Bài 1 (5,0 điểm)
1. Nhận biết các dung dịch loãng không màu đựng trong các lọ mất nhãn:
Al2(SO4)3, (NH4)2SO4, FeCl3, NH4NO3, Al(NO3)3, KNO3
2. Nêu hiện tượng và viết phương trình phản ứng xảy ra trong các thí nghiệm sau:
a) Cho từ từ đến dư dung dịch KHSO4 vào dung dịch chứa NaAlO2 và Na2CO3.
b) Cho dung dịch H2SO4 loãng vào dung dịch Fe(NO3)2.
c) Sục khí etilen vào dung dịch brom.
d) Toluen tác dụng với dung dịch KMnO4 khi đun nóng
3. Cho dung dịch H3PO4 0,005M . Biết axit này có thể phân li 3 nấc :
H3PO4 ⇔ H+ + H2PO4- \({K_{{a_1}}} = 7,{6.10^{ - 3}}\)
H2PO4- ⇔ H+ + HPO42- \[{K_{a{2_{}}}} = 6,{2.10^{ - 8}}\]
HPO42- ⇔ H+ + PO43-
a) Tính Hằng số cân bằng của quá trình: H3PO4 ⇔ 3H+ + PO43-
b) Tính pH và nồng độ [HPO42-] của dung dịch trên.
Bài 2 (5,0 điểm):
1. Tại sao khi đất chua người ta thường bón vôi? Dựa vào kiến thức hóa học, hãy dự đoán 4 dạng vôi có thể bón để làm giảm tính chua của đất?
2. Hoàn thành sơ đồ chuyển hóa (ghi rõ điều kiện, các chất hữu cơ viết công thức ở dạng cấu tạo)
NaNO3 → HNO3 → CO2 → C → CaC2 → C2H2 → C4H4 → C4H6 → Cao su buna
3. Quan sát hình vẽ điều chế khí X dưới đây, hãy trả lời các câu hỏi sau đây:
.png)
a. Khí X là gì? Viết PTHH minh họa
b. Vai trò của đá bọt? Nếu phòng thí nghiệm không có đá bọt em có thể thay bằng gì?
c. Nêu hiện tượng và viết PTHH khi dẫn khí X vào ống nghiệm đựng dung dịch KMnO4.
d. Để thu được khí X tinh khiết người ta thường dẫn khí thu được vào bình rửa đựng dung dịch gì? Giải thích?
Bài 3 (5,0 điểm):
1. Cho 6,72 lít (đktc) hỗn hợp X gồm C2H2 và H2 qua bình đựng Ni (nung nóng), thu được hỗn hợp Y (chỉ chứa ba hiđrocacbon) có tỉ khối so với H2 là 14,4. Biết Y phản ứng tối đa với a mol Br2 trong dung dịch. Tính giá trị của a?
2. Dung dich X chứa KHCO3 và Na2CO3. Dung dịch Y chứa HCl 1M và H2SO4 1,25M. Thực hiện 2 thí nghiệm sau:
+ Cho từ từ 100 ml dung dịch X vào 100 ml dung dịch Y thu được 5,6 lít CO2 (đktc).
+ Cho từ từ 100 ml dung dịch Y vào 100 ml dung dịch X thu được 3,36 lít CO2 (đktc) và dung dịch Z. Cho Ba(OH)2 dư vào dung dịch Z, kết thúc phản ứng thu được m gam kết tủa. Tính giá trị m ?
3. Sục V lít khí CO2 (đktc) vào dung dịch chứa hỗn hợp Ba(OH)2 và KOH, kết quả thí nghiệm được biểu diễn bằng đồ thị sau:
.png)
Khi kết tủa đạt cực đại, hãy tính giá trị trị lớn nhất và nhỏ nhất của V ?
Bài 4 (5,0 điểm):
1. Hòa tan hết 33,02 gam hỗn hợp Na, Na2O, Ba và BaO vào nước dư thu dược dung dịch X và 4,48 lit H2 ở (đktc). Cho dung dịch CuSO4 dư vào dung dịch X, thu được 73,3 gam kết tủa. Nếu sục 0,45 mol khí CO2 vào dung dịch X, sau khi kết thúc phản ứng, thu được bao nhiêu gam kết tủa?
2. Trong bình kín thể tích là 10 lít chứa không khí (20% O2 và 80% N2 theo thể tích) và 1,54 gam chất X (chứa C, H, O, N; tương ứng với 0,02 mol, thể khí) ở áp suất P, nhiệt độ 54,60C. Bật tia lửa điện để đốt cháy hết X. Sau đó cho toàn bộ sản phẩm cháy qua lần lượt bình 1 đựng P2O5 dư, bình 2 đựng 400 ml dung dịch Ba(OH)2 0,075M và bình 3 đựng photpho dư đun nóng, khí còn lại là N2 có thể tích là 5,6 lít (đktc). Cho các phản ứng xảy ra hoàn toàn, hãy xác định giá trị của P. Biết bình 1 tăng 1,26 gam, bình 2 tạo 3,94 gam kết tủa và khi đun nóng dung dịch sau phản ứng lại có kết tủa xuất hiện, bình 3 tăng 0,16 gam.
3. Hòa tan hết 14,3g hỗn hợp X gồm Al(NO3)3, MgO, Mg và Al vào dung dịch gồm 0,03mol KNO3 và 0,5 mol H2SO4 (đun nóng). Sau khi kết thúc phản ứng thu được dung dịch Y chỉ chứa 59,85g muối và 3,584 lít (đktc) hỗn hợp khí Z gồm NO và H2 có tỉ khối so với H2 bằng 4,5. Dung dịch Y tác dụng với dung dịch KOH dư, lấy kết tủa nung ngoài không khí tới khối lượng không đổi thu được 10 gam rắn. Tính phần trăm khối lượng của Al có trong X ?
...
Trên đây là một phần trích đoạn nội dung Bộ 3 đề thi HSG lần 2 môn Hóa học 11 năm 2019-2020 Trường THPT Lam Kinh. Để xem toàn bộ nội dung các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập.
Chúc các em học tập tốt !







