Thạch nhũ trong các hang động có thành phần chính là muối của calcium, nước biển chứa muối ăn và nhiều muối khác. Trong tự nhiên, các kim loại thường tồn tại dưới dạng muối. Muối là gì? Muối có thành phần tính chất và mối quan hệ với acid, base, oxide như thế nào? Chúng ta hãy cùng tìm hiểu qua bài học dưới đây Bài 13: Muối trong chương trình Khoa học tự nhiên 8 Chân trời sáng tạo.
Tóm tắt lý thuyết
1.1. Khái niệm muối
a. Tìm hiểu về muối
Muối là hợp chất được tạo ra khi thay thế ion H+ trong acid bằng ion kim loại hoặc ion ammonium (NH4+).
b. Tìm hiểu tên gọi của muối
- Cách gọi muối của kim loại:
Tên kim loại + hóa trị (kim loại có nhiều hóa trị) + tên gốc acid
- Cách gọi tên muối của ammonium (NH+4)
ammonium + tên gốc acid
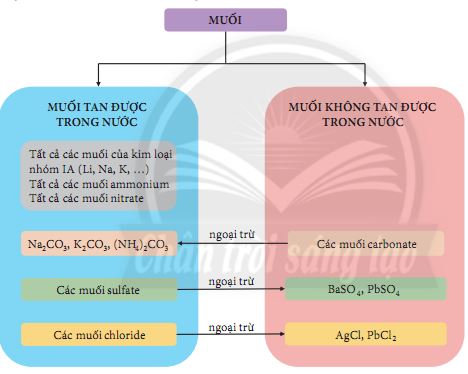
1.2. Tính tan trong muối
Tuỳ thuộc vào khả năng tan trong nước của muối, ta có: muối tan, muối không tan hoặc ít tan.
Tổng kết tính tan của một số muối trong nước
1.3. Điều chế muối
- Các phương pháp điều chế muối
+ Oxide acid:
Oxide acid + Base \( \to \) Muối + H2O
+ Oxide base
Oxide base + Acid \( \to \) Muối + H2O
+ Dung dịch acid và base:
Acid + Base \( \to \) Muối + H2O
+ Kim loại và acid:
M + (HCl, H2SO4 loãng,...) \( \to \) Muối + H2\( \uparrow \)
M là một số kim loại như Mg, Al, Zn, Fe,…
1.4. Tính chất hóa học của muối
- Dung dịch muối phản ứng với kim loại (KL):
Muối KL(A) + KL(B) → Muối KL(B) + KL(A)
- Dung dịch muối phản ứng với dung dịch base:
Muối + Base → Muối mới + Base mới
- Dung dịch muối phản ứng với dung dịch acid:
Muối + Acid → Muối mới + Acid mới
- Dung dịch muối phản ứng với dung dịch muối:
Muối(A) + Muối(B) → Muối(C) + Muối(D)
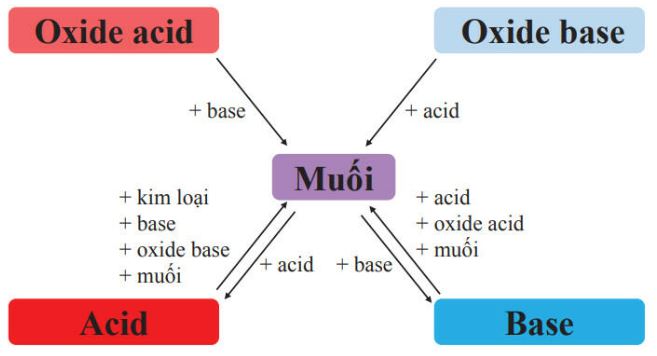
1.5. Mối quan hệ giữa Acid, Base, Oxide và muối
Hình. Sơ đồ quan hệ giữa Acid, Base, Oxide và muối
Bài tập minh họa
Ví dụ 1: Cho 35 gam CaCO3 vào dung dịch HCl dư, kết thúc phản ứng thu được bao nhiêu lít khí CO2 ở đktc?
Hướng dẫn giải
Số mol của CaCO3 là:
nCaCO3 = 35/100 = 0,35 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có:
nCO2= 0,35 mol
Thể tích khí CO2 ở đktc là:
VCO2= 0,35.22,4 = 7,84 lít.
Ví dụ 2: Tính chất hóa học của muối là
A. Tác dụng với kim loại
B. Tác dụng với axit
C. Tác dụng với dung dịch bazơ
D. A, B, C đều đúng
Hướng dẫn giải
Dung dịch muối phản ứng với kim loại, base, acid, muối
Đáp án D
Luyện tập Bài 13 Khoa học tự nhiên 8 Chân trời sáng tạo
Học xong bài này các em cần biết:
– Nêu được khái niệm về muối.
– Chỉ ra được một số muối tan và muối không tan từ bảng tính tan.
– Trình bày được một số phương pháp điều chế muối.
– Đọc được tên một số loại muối thông dụng.
– Tiến hành được thí nghiệm muối phản ứng với kim loại, với acid, với base, với muối; nêu và giải thích được hiện tượng xảy ra trong thí nghiệm và rút ra kết luận về tính chất hoá học của muối.
– Trình bày được mối quan hệ giữa acid, base, oxide và muối; rút ra được kết luận về tính chất hoá học của acid, base, oxide.
3.1. Trắc nghiệm Bài 13 Khoa học tự nhiên 8 Chân trời sáng tạo
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm KHTN 8 Chân trời sáng tạo Bài 13 cực hay có đáp án và lời giải chi tiết.
-
- A. Ca(OH)2.
- B. Fe2O3.
- C. H2SO4.
- D. CaCl2.
-
Câu 2:
Cho dãy các chất: KCl, Cu(OH)2, BaO, MgCO3, ZnCl2, KOH, CuSO4, NH4NO3. Số lượng muối có trong dãy là
- A. 3
- B. 4
- C. 5
- D. 6
-
- A. sodium sulfate.
- B. sodium sulfite.
- C. potassium sulfate.
- D. sodium sulfuric.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 13 Khoa học tự nhiên 8 Chân trời sáng tạo
Các em có thể xem thêm phần hướng dẫn Giải bài tập KHTN 8 Chân trời sáng tạo Bài 13 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Đang cập nhật câu hỏi và gợi ý làm bài.
Hỏi đáp Bài 13 Khoa học tự nhiên 8 Chân trời sáng tạo
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Khoa học tự nhiên HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!