Mß╗Öt sß╗æ oxide phß╗Ģ biß║┐n tß║Īo n├¬n c├Īc kho├Īng chß║źt nhŲ░ ─æ├Ī granite v├Ā thß║Īch anh (oxide cß╗¦a silicon), gß╗ē sß║»t (oxide cß╗¦a sß║»t) v├Ā ─æ├Ī v├┤i (oxide cß╗¦a calcium v├Ā carbon). ─É├Ī ruby tß╗▒ nhi├¬n c├│ dß║Żi m├Āu tß╗½ hß╗ōng ─æß║Łm tß╗øi ─æß╗Å sß║½m do th├Ānh phß║¦n c├Īc oxide cß╗¦a aluminium, chromium, ... tß║Īo n├¬n. Oxide l├Ā g├¼? C├│ nhß╗»ng loß║Īi oxide n├Āo? Ch├║ng c├│ sß║Ąn trong tß╗▒ nhi├¬n hay phß║Żi ─æiß╗üu chß║┐? Ch├║ng ta h├Ży c├╣ng t├¼m hiß╗āu qua b├Āi hß╗Źc dŲ░ß╗øi ─æ├óy B├Āi 12: Oxide trong chŲ░ŲĪng tr├¼nh Khoa hß╗Źc tß╗▒ nhi├¬n 8 Ch├ón trß╗Øi s├Īng tß║Īo.
T├│m tß║»t l├Į thuyß║┐t
1.1. Kh├Īi niß╗ćm Oxide - PhŲ░ŲĪng tr├¼nh h├│a hß╗Źc tß║Īo oxide
a. T├¼m hiß╗āu kh├Īi niß╗ćm Oxide
H├¼nh 12.1. Mß╗Öt sß╗æ hß╗Żp chß║źt c├│ chŲ░a nguy├¬n tß╗æ oxygen
- Oxide l├Ā hß╗Żp chß║źt gß╗ōm 2 nguy├¬n tß╗æ, trong ─æ├│ c├│ nguy├¬n tß╗æ oxygen.
- C├┤ng thß╗®c ho├Ī hß╗Źc chung cß╗¦a oxide l├Ā MXOY
b. T├¼m hiß╗āu phß║Żn ß╗®ng tß║Īo Oxide
H├¼nh 12.2. ─Éß╗æt d├óy ─æß╗ōng
H├¼nh 12.3. ─Éß╗æt than gß╗Ś trong kh├┤ng kh├Ł
C├Īc phß║Żn ß╗®ng ho├Ī hß╗Źc tß║Īo oxide:
- Kim loß║Īi phß║Żn ß╗®ng vß╗øi oxygen
Kim loß║Īi + O2 \(\xrightarrow{t^0}\) Oxide kim loß║Īi
Phß║Żn ß╗®ng tr├¬n xß║Ży ra vß╗øi hß║¦u hß║┐t c├Īc kim loß║Īi (trß╗½ Au, Pt, Ag).
- Phi kim phß║Żn ß╗®ng vß╗øi oxygen
Phi kim + O2 \(\xrightarrow{t^0}\) Oxide phi kim
C├Īc phi kim thŲ░ß╗Øng gß║Ęp: C, S, B ...
1.2. Ph├ón loß║Īi Oxide
H├¼nh 12.4. D├╣ng giß║źm ─ān ─æß╗ā tß║®y gß╗ē s├®t tr├¬n bß╗ü mß║Ęt ─æß╗ō d├╣ng l├Ām bß║▒ng sß║»t - th├®p
- C├│ 4 loß║Īi oxide:
+ Oxide acid l├Ā oxide phß║Żn ß╗®ng ─æŲ░ß╗Żc vß╗øi dung dß╗ŗch base tß║Īo ra muß╗æi v├Ā nŲ░ß╗øc.
+ Oxide base l├Ā oxide phß║Żn ß╗®ng ─æŲ░ß╗Żc vß╗øi dung dß╗ŗch acid tß║Īo ra muß╗æi v├Ā nŲ░ß╗øc.
+ Oxide lŲ░ß╗Īng t├Łnh (amphoteric oxide) l├Ā c├Īc oxide vß╗½a phß║Żn ß╗®ng ─æŲ░ß╗Żc vß╗øi dung dß╗ŗch acid vß╗½a phß║Żn ß╗®ng ─æŲ░ß╗Żc vß╗øi dung dß╗ŗch base ─æß╗üu tß║Īo ra muß╗æi v├Ā nŲ░ß╗øc.
+ Oxide trung t├Łnh (neutral oxide) l├Ā c├Īc oxide kh├┤ng phß║Żn ß╗®ng ─æŲ░ß╗Żc vß╗øi dung dß╗ŗch acid v├Ā dung dß╗ŗch base.
1.3. T├Łnh chß║źt h├│a hß╗Źc cß╗¦a Oxide
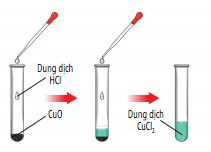
H├¼nh 12.5. CuO phß║Żn ß╗®ng vß╗øi dung dß╗ŗch HCl
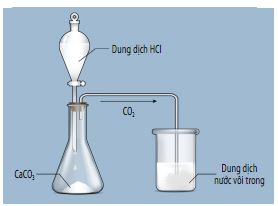
H├¼nh 12.6. Th├Ł nghiß╗ćm ─æiß╗üu chß║┐ CO2 v├Ā thß╗Ł t├Łnh chß║źt cß╗¦a CO2
- Oxide base phß║Żn ß╗®ng vß╗øi dung dß╗ŗch acid tß║Īo ra muß╗æi cß╗¦a acid tŲ░ŲĪng ß╗®ng v├Ā nŲ░ß╗øc.
- Oxide acid phß║Żn ß╗®ng vß╗øi dung dß╗ŗch base tß║Īo ra muß╗æi cß╗¦a acid tŲ░ŲĪng ß╗®ng v├Ā nŲ░ß╗øc.
B├Āi tß║Łp minh hß╗Źa
V├Ł dß╗ź 1: Lß║Łp CTHH cß╗¦a hß╗Żp chß║źt: Nh├┤m oxit ─æŲ░ß╗Żc tß║Īo n├¬n tß╗Ł 2 nguy├¬n tß╗æ nh├┤m v├Ā oxi.
HŲ░ß╗øng dß║½n giß║Żi
Theo quy tß║»c h├│a trß╗ŗ:
x . III = y . II
=> x = 2; y = 3
Vß║Ły CTHH: Al2┬ŁO3
V├Ł dß╗ź 2: CaO l├Ā oxide:
A. Oxide acid
B. Oxit base
C. Oxit trung t├Łnh
D. Oxit lŲ░ß╗Īng t├Łnh
HŲ░ß╗øng dß║½n giß║Żi
CaO l├Ā Oxit base
─É├Īp ├Īn B
Luyß╗ćn tß║Łp B├Āi 12 Khoa hß╗Źc tß╗▒ nhi├¬n 8 Ch├ón trß╗Øi s├Īng tß║Īo
Hß╗Źc xong b├Āi n├Āy c├Īc em cß║¦n biß║┐t:
ŌĆō N├¬u ─æŲ░ß╗Żc kh├Īi niß╗ćm oxide.
ŌĆō Viß║┐t ─æŲ░ß╗Żc phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc tß║Īo oxide tß╗½ kim loß║Īi/phi kim vß╗øi oxygen.
ŌĆō Ph├ón loß║Īi oxide (theo khß║Ż n─āng phß║Żn ß╗®ng vß╗øi dung dß╗ŗch acid/base).
ŌĆō Tiß║┐n h├Ānh ─æŲ░ß╗Żc th├Ł nghiß╗ćm oxide kim loß║Īi phß║Żn ß╗®ng vß╗øi dung dß╗ŗch acid; oxide phi kim phß║Żn ß╗®ng vß╗øi dung dß╗ŗch base; n├¬u v├Ā giß║Żi th├Łch ─æŲ░ß╗Żc hiß╗ćn tŲ░ß╗Żng xß║Ży ra trong th├Ł nghiß╗ćm (viß║┐t phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc) v├Ā r├║t ra nhß║Łn x├®t vß╗ü t├Łnh chß║źt ho├Ī hß╗Źc cß╗¦a oxide.
3.1. Trß║»c nghiß╗ćm B├Āi 12 Khoa hß╗Źc tß╗▒ nhi├¬n 8 Ch├ón trß╗Øi s├Īng tß║Īo
C├Īc em c├│ thß╗ā hß╗ć thß╗æng lß║Īi nß╗Öi dung kiß║┐n thß╗®c ─æ├Ż hß╗Źc ─æŲ░ß╗Żc th├┤ng qua b├Āi kiß╗ām tra Trß║»c nghiß╗ćm KHTN 8 Ch├ón trß╗Øi s├Īng tß║Īo B├Āi 12 cß╗▒c hay c├│ ─æ├Īp ├Īn v├Ā lß╗Øi giß║Żi chi tiß║┐t.
-
- A. Muối.
- B. Acid.
- C. Base.
- D. Oxide.
-
- A. t├Īc dß╗źng vß╗øi dung dß╗ŗch acid tß║Īo th├Ānh muß╗æi v├Ā nŲ░ß╗øc.
- B. t├Īc dß╗źng vß╗øi dung dß╗ŗch base tß║Īo th├Ānh muß╗æi v├Ā nŲ░ß╗øc.
- C. kh├┤ng t├Īc dß╗źng vß╗øi dung dß╗ŗch base v├Ā dung dß╗ŗch acid.
- D. chß╗ē t├Īc dß╗źng ─æŲ░ß╗Żc vß╗øi muß╗æi.
-
- A. CO2.
- B. CO.
- C. C2O.
- D. H2CO3.
C├óu 4-10: Mß╗Øi c├Īc em ─æ─āng nhß║Łp xem tiß║┐p nß╗Öi dung v├Ā thi thß╗Ł Online ─æß╗ā cß╗¦ng cß╗æ kiß║┐n thß╗®c vß╗ü b├Āi hß╗Źc n├Āy nh├®!
3.2. B├Āi tß║Łp SGK B├Āi 12 Khoa hß╗Źc tß╗▒ nhi├¬n 8 Ch├ón trß╗Øi s├Īng tß║Īo
C├Īc em c├│ thß╗ā xem th├¬m phß║¦n hŲ░ß╗øng dß║½n Giß║Żi b├Āi tß║Łp KHTN 8 Ch├ón trß╗Øi s├Īng tß║Īo B├Āi 12 ─æß╗ā gi├║p c├Īc em nß║»m vß╗»ng b├Āi hß╗Źc v├Ā c├Īc phŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp.
─Éang cß║Łp nhß║Łt c├óu hß╗Åi v├Ā gß╗Żi ├Į l├Ām b├Āi.
Hß╗Åi ─æ├Īp B├Āi 12 Khoa hß╗Źc tß╗▒ nhi├¬n 8 Ch├ón trß╗Øi s├Īng tß║Īo
Trong qu├Ī tr├¼nh hß╗Źc tß║Łp nß║┐u c├│ thß║»c mß║»c hay cß║¦n trß╗Ż gi├║p g├¼ th├¼ c├Īc em h├Ży comment ß╗¤ mß╗źc Hß╗Åi ─æ├Īp, Cß╗Öng ─æß╗ōng Khoa hß╗Źc tß╗▒ nhi├¬n HOC247 sß║Į hß╗Ś trß╗Ż cho c├Īc em mß╗Öt c├Īch nhanh ch├│ng!
Ch├║c c├Īc em hß╗Źc tß║Łp tß╗æt v├Ā lu├┤n ─æß║Īt th├Ānh t├Łch cao trong hß╗Źc tß║Łp!





.JPG)

.JPG)