Mời các em học sinh cùng tham khảo Đề thi học sinh giỏi môn Hóa học 8- Phòng GD & ĐT Bình Xuyên có đáp án được HOC247 tổng hợp bên dưới đây. Tài liệu gồm các câu hỏi hay và khó có đáp án chi tiết, hi vọng sẽ giúp các em ôn tập thật hiệu quả.
PHÒNG GD & ĐT BÌNH XUYÊN
ĐỀ THI HỌC SINH GIỎI CẤP HUYỆN
MÔN HÓA HỌC 8
THỜI GIAN: 120 PHÚT
Câu 1. (1 điểm): Các câu nói sau đây đúng hay sai, sửa lại các câu cho đúng.
a) Nước mía nguyên chất.
b) Trong chất đồng sunfat có đơn chất đồng và phân tử gốc axit.
c) Oxit bazơ kết hợp với nước bằng bazơ tương ứng.
d) Hỗn hợp gồm nhiều nguyên tử khác loại.
Câu 2. (2 điểm)
a) Một khoáng vật có thành phần về khối lượng là: 13,77% Na; 7,18% Mg;
57,48% O; 2,39% H và còn lại là một nguyên tố khác. Xác định công thức hóa học của khoáng vật đó.
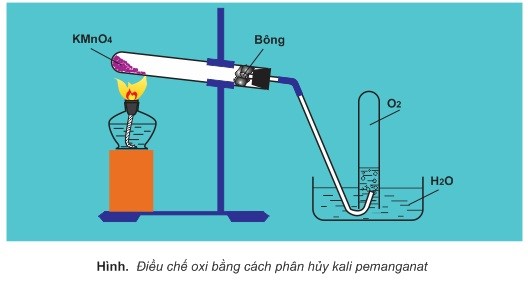
b) Em hãy vẽ cách lắp đặt dụng cụ điều chế oxi từ kalipemanganat và thu khí oxi bằng phương pháp đẩy nước.
Câu 3. ( 1,5 điểm). Xác định tên nguyên tố trong các trường hợp sau:
a) Nguyên tố X có điện tích hạt nhân nguyên tử là: +1,2816.10-18C
b) Nguyên tử Y có tổng số proton, nơtron, electron trong nguyên tử là 34
c) Nguyên tố Z tạo thành hai loại oxit là ZOx, ZOy lần lượt chứa 50% và 60% oxi về khối lượng trong các oxit.
Câu 4. (1,5 điểm): Cho dòng khí H2 dư, đi qua 54,4 gam hỗn hợp bột CuO và một oxit sắt nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, thu được 40 gam chất rắn và m gam nước. Cho lượng chất rắn thu được tác dụng với dung dịch axit clohiđric dư, thu được m1 gam chất rắn không tan và 13,44 lít khí H2(đktc).
a) Viết các phương trình phản ứng xảy ra.
b) Xác định công thức oxit sắt, tính m và m1.
Câu 5. (2,5 điểm): Nguyên tử nguyên tố X có tổng số hạt proton, nơtron và electron bằng 93, trong đó tổng các hạt mang điện gấp 1,657 lần số hạt không mang điện.
a) Xác định nguyên tố X.
b) Cho 0,2 mol XO (ở câu trên) tan trong H2SO4 20% vừa đủ, đun nóng. Sau đó làm nguội dung dịch thu được đến 100C. Tính khối lượng tinh thể XSO4.5H2O tách ra khỏi dung dịch, biết độ tan của XSO4 ở 100C là 17,4 gam.
Câu 6. (1,5 điểm): Lập biểu thức mối quan hệ giữa nồng độ phần trăm và nồng độ mol/l. Áp dụng tính nồng độ mol/l của dung dịch NaOH 20%, có D = 1,225g/ml.
ĐÁP ÁN
|
Câu |
Đáp án |
Điểm |
|
Câu 1 (1 đ) |
- Nước mía là hỗn hợp gồm nước, đường ngoài ra còn có một số nguyên tố vi lượng khác như Ca, Mg, Zn… - Trong phân tử đồng sunfat gồm nguyên tử đồng liên kết với gôc axit. - Oxit bazơ tác dụng với nước tạo thành bazơ tương ứng. - Hỗn hợp gồm hai hay nhiều chất trộn lẫn vào nhau. |
0,25 0,25 0,25 0,25 |
|
Câu 2
|
a. Gọi công thức của nguyên tố trong khoáng chất là X ta có %X= 19,18% => công thức chung của khoáng chất là NaxMgyMzOnHt (trong đó M là nguyên tử khối của X) ta có tỉ lệ: x:y:z:n:t \(\frac{{13,77}}{{23}}:\frac{{7,18}}{{24}}:\frac{{19,18}}{M}:\frac{{57,48}}{{16}}:\frac{{2,39}}{1}\) \(= 0,599:0,299:\frac{{19,18}}{M}:3,59:2,39\) \( = 2:1:k:12:8\) Tổng số oxi hóa bằng 0 (với a là hóa trị của X) nên: 2(+1) + 1(+2)+k(a)+ 12(-2)+8(+1) =0=> ka=12 Với: k= 19,18/(M.0,299) = 64/M => M= 16a/3 => chỉ có a= +6 =>M=32 là thích hợp. Vậy X là S => K=2 Vậy khoáng vật có công thức: Na2MgS2O12H8 b. Hình vẽ:chú ý đáy ống nghiệm cao hơn miệng ống nghiệm
|
0,5 đ
0,5 đ
1 đ |
|
Câu 3 (1,5 đ) |
a. Điện tích hạt nhân chính là điện tích của proton khi đó ta có: số PX = (1,2816.10-18)/(1,602.10-19) = 0,8.10 = 8 => X là Oxi b. Tổng số hạt proton, nơtron, electron trong nguyên tử Y là p+n+e = 34 (1) mặt khác ta có \(1 \leqslant \frac{n}{p}\) <1,5 (2) Từ (1) => 2p+n=34 => n= 34-2p => thay vào (2) \(1 \leqslant \frac{{34 - 2p}}{p}\)<1,5 (*) => giải (*) ta được 9,7 - Với p = 10 (loại) - Với p = 11 (nghiệm) => Y là Na c. Phần trăm của oxi trong ZOx : 16x / (z + 16x).100% = 50% 0,5Z=8x vậy với x = 1 => Z = 16 (loại) với x=2 => Z= 32 ( S) => oxit là SO2 - Phần trăm oxi trong ZOy. ( Z=32) 16y/(32 + 16y).100% = 60% =>6,4 y =19,2 => y = 3 công thức oxit là SO3. |
0,5 đ
0,5 đ
0,5 đ |
|
Câu 4 1,5 đ |
a. Gọi công thức oxit sắt là FexOy, các phản ứng xảy ra: H2 + CuO \(\xrightarrow{{{t^o}}}\) Cu + H2O (1) yH2 + FexOy \(\xrightarrow{{{t^o}}}\) xFe + yH2O (2) Chất rắn là Fe và Cu cho phản ứng với HCl chỉ có Fe phản ứng Fe + 2HCl → FeCl2 + H2 (3) b. nH2 = 13,44/22,4 = 0,6 (mol) - Theo (3) số mol Fe = số mol H2 = 0,6 (mol) =>mFe= 0,6.56= 33,6 gam = mCu = 40-33,6 = 6,4 gam - Khối lượng của (O) trong oxit sắt = 54,4 – mCuO – mFe =54,4- 8 – 33,6 = 12,8 gam => nO(Fe2O3) = 12,8/16 =0,8 => Vậy tỉ lệ x: y = 0,6: 0,8 = 3:4 => oxit sắt là Fe3O4 m = mH2O , mặt khác số mol oxi trong oxit = 0,8 + 0,1=0,9 m= 0,9.18 = 16,2 (gam) m1 = mCu = 6,4 (gam)
|
0,5 đ
0,5 đ
0,5 đ
|
|
Câu 5 (2,5 đ) |
a. Ta có tổng hạt trong nguyên tử: p + n + e = 93 (1) mà p =e => 2p + n= 93 (2) - Mặt khác 2p = 1,657n (3) => giải (2) và (3) ta được p= 29, n= 35 là (Cu) b. Oxit là CuO CuO + H2SO4 → CuSO4 + H2O (*) - Khối lượng dung dịch sau phản ứng = 0,2.98.100/20 +0,2.80= 114 (gam) - Khối lượng CuSO4 = 0,2.160 = 32 gam - Khối lượng H2O trong dung dịch = 114 – 32 = 82 gam - Gọi số mol CuSO4.5H2O = x mol => khối lượng CuSO4 kết tinh = 160x => khối lượng H2O kết tinh = 90x => Khối lượng CuSO4 còn lại trong dd ở 100C = 32-160x => Khối lượng H2O trong dung dịch ở 100C = 82-90x Vậy ta có (32 – 160x)/(82 – 90x) = 17,4/100 => x= 0,1228 - Khối lượng muối kết tinh = 0,1228.250 = 30,7 (gam) |
0,5 đ
0,5 đ
0,5 đ
0,5 đ
0,5 đ |
|
Câu 6 (1,5 đ) |
* Ta có công thức nồng độ % và nồng độ mol/l: C% = mct /mdd /100% (1) ; CM = n/V (2) - Mặt khác mdd = V.D (3); mct =n.Mct (4) - Từ (2) => V = 1000.n/CM (5) => mdd = 1000.n.D/CM (6) - Thay (4), (6) vào (1) ta có: => C% = CM.Mct /10D (7) và => CM = C%.10D/Mct (8) * Áp dụng (8) ta có: CM = (10.1,225)/40.20 = 6,125 M |
0,5 đ
0,5 đ 0,5 đ |
Trên đây là toàn bộ nội dung tài liệu Đề thi học sinh giỏi cấp huyện môn Hóa học 8- Phòng GD & ĐT Bình Xuyên có đáp án. Để xem thêm nhiều tài liệu tham khảo hữu ích khác các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Ngoài ra các em học sinh có thể tham khảo các tài liệu cùng chuyên mục:
- Đề thi học sinh giỏi môn Hóa học 8- Phòng GD & ĐT Lập Thạch có đáp án
- Đề thi học sinh giỏi môn Hóa học 9- Trường THCS Trần Quốc Tuấn có đáp án
Chúc các em học tốt!